
【题目】硼元素的单质和化合物很多,我们可以利用所学知识认识和理解它们。
(1)硼元素位于元素周期表的__________区;硼元素的价电子排布式为_________。
(2)B、C、Si与H、O原子形成的单键和B、C、Si原子自成单键的键能如下表所示:
化学键 |
|
|
|
|
|
|
|
|
|
键能 | 389 | 411 | 318 | 561 | 358 | 452 | 293 | 346 | 222 |
①自然界中硼主要以含氧化合物的形式存在的原因是_____________。
②类似于烷烃,B、Si也有一系列氢化物,但从物质数量角度看:硅烷<硼烷<烷烃。原因是_________。
③推测晶体B的晶体类型是__________。
(3)乙硼烷![]() 具有强还原性,它和氢化锂反应生成硼氢化锂
具有强还原性,它和氢化锂反应生成硼氢化锂![]() ,硼氢化锂常用于有机合成。
,硼氢化锂常用于有机合成。![]() 由
由![]() 和
和![]() 构成。
构成。![]() 中B原子的杂化轨道类型为_______;
中B原子的杂化轨道类型为_______;![]() 中三种元素电负性由大到小的顺序是__________(写元素符号)。
中三种元素电负性由大到小的顺序是__________(写元素符号)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到:![]()
①□内物质的空间构型为__________。
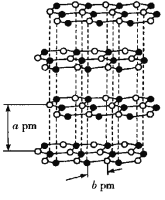
②在与石墨结构相似的六方氮化硼晶体中,晶体的层间距为a pm,![]() 键键长为b pm,则六方氮化硼晶体的密度为__________
键键长为b pm,则六方氮化硼晶体的密度为__________![]() (用
(用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
【答案】p ![]()
![]() 键键能很大,导致B主要以含氧化合物的形式存在
键键能很大,导致B主要以含氧化合物的形式存在 ![]() 、
、![]() 键的键能比
键的键能比![]() 、
、![]() 键的键能大,但比
键的键能大,但比![]() 、
、![]() 键的键能小,因此硼烷虽有一定数量,但少于烷烃,多于硅烷 原子晶体
键的键能小,因此硼烷虽有一定数量,但少于烷烃,多于硅烷 原子晶体 ![]()
![]() 三角锥形
三角锥形 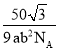
【解析】
(1)根据B的核外电子排布式可知;
(2)根据键能判断;
(3)根据价层电子对数判断杂化轨道类型;根据LiBH4中B和H的化合价判断电负性;
(4)①根据元素守恒可知方框内的物质是![]() ,其空间构型为三角锥形。②计算六棱柱体积和一个六棱柱的质量即可计算密度。
,其空间构型为三角锥形。②计算六棱柱体积和一个六棱柱的质量即可计算密度。
(1)硼元素位于第ⅢA族,位于元素周期表的p区;硼元素的核外电子排布式为1s22s22p1,价电子排布式为2s22p1。
答案:p 2s22p1
(2)①自然界中硼主要以含氧化合物的形式存在的原因是B-O键键能很大,导致B主要以含氧化合物的形式存在;
答案:B-O键键能很大,导致B主要以含氧化合物的形式存在
②B-B、B-H键的键能比Si-Si、Si-H键的键能大,但比C-C、C-H键的键能小,因此硼烷虽有一定数量,但少于烷烃,多于硅烷;
答案:B-B、B-H键的键能比Si-Si、Si-H键的键能大,但比C-C、C-H键的键能小,因此硼烷虽有一定数量,但少于烷烃,多于硅烷
③B-B的键能比Si-Si的键能还大,根据键能数据可判断出B是原子晶体;
答案:原子晶体
(3)BH4-中B原子的价层电子对数为4,则其杂化轨道类型为sp3杂化。LiBH4中阴离子为BH4-,显然B是![]() 价,H是
价,H是![]() 价,所以H的电负性大于B。而Li是金属元素,其电负性必定小于B的电负性。
价,所以H的电负性大于B。而Li是金属元素,其电负性必定小于B的电负性。
答案:sp3 H>B>Li
(4)①根据元素守恒可知方框内的物质是![]() ,其空间构型为三角锥形。②以一个六棱柱为研究对象,每一层的底面为正六边形,其面积为6×1/2×b2×sin60°=
,其空间构型为三角锥形。②以一个六棱柱为研究对象,每一层的底面为正六边形,其面积为6×1/2×b2×sin60°=![]() b2pm2,六棱柱的高为a pm,六棱柱的体积为V=
b2pm2,六棱柱的高为a pm,六棱柱的体积为V=![]() ab2pm3。一个六棱柱中平均拥有1个B原子、1个N原子,一个六棱柱的质量m=
ab2pm3。一个六棱柱中平均拥有1个B原子、1个N原子,一个六棱柱的质量m=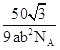 ;
;
答案:三角锥形 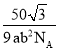


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。
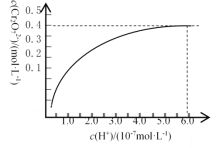
②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
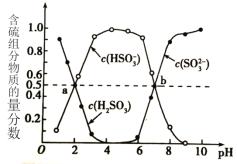
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y两种元素可形成数目庞大的化合物“家族”,Z、W可形成常见的离子化合物Z2W。下列有关说法正确的是
A.Y元素至少能形成三种单质
B.简单离子半径:![]()
C.元素的非金属性:![]()
D.化合物ZX中,阴、阳离子的电子层结构相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。W、D、E三种元素的简单离子的离子半径由大到小顺序为______________(用离子符号表示)
(2)由A、B、W三种元素组成的18电子微粒的电子式为_____________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,该反应的化学方程式为______________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质间转化的化学化学方程式,并注明反应条件.
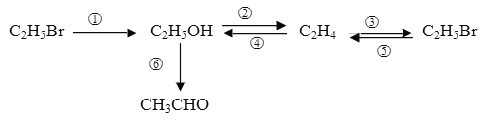
① ________________________________________________________ ;
② ________________________________________________________ ;
⑤ ________________________________________________________ ;
⑥ ________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素是一种具有保护心肌、抗血栓形成、抗肿瘤等多种作用的药物。它的一种合成路线如下:
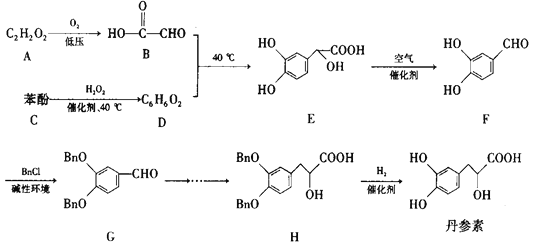
已知:Bn-代表苄基(![]() )
)
请回答下列问题:
(1)D的结构简式为__________,H中所含官能团的名称为_______________。
(2)![]() 的反应类型为_____________,该反应的目的是_____________。
的反应类型为_____________,该反应的目的是_____________。
(3)A的名称是__________,写出![]() 的化学方程式:________。
的化学方程式:________。
(4)用苯酚与B可以制备物质M(![]() )。N是M的同系物,相对分子质量比M大14.则符合下列条件的N的同分异构体有__________种(不考虑立体异构)。其中核磁共振氢谱有6组峰,且峰面积之比为1:1:1:2:2:3的物质的结构简式是_____________(写出一种即可)。
)。N是M的同系物,相对分子质量比M大14.则符合下列条件的N的同分异构体有__________种(不考虑立体异构)。其中核磁共振氢谱有6组峰,且峰面积之比为1:1:1:2:2:3的物质的结构简式是_____________(写出一种即可)。
①苯环只有两个取代基
②能与![]() 溶液发生显色反应
溶液发生显色反应
③能发生银镜反应
④红外光谱表明分子中不含醚键
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________________。
的合成路线:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是
A.Mc的最低负化合价为-3B.Mc的最高价氧化物的化式为Mc2O 5
C.![]() 的中子数为115D.通过化学反应可使
的中子数为115D.通过化学反应可使![]() 转化为
转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、R、W、G在周期表中的相对位置如图所示。下列说法正确的是
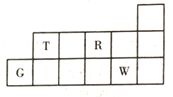
A.T的氢化物的沸点一定低于R的
B.W的氧化物对应的水化物一定是强酸
C.T和W组成的化合物含两种化学键
D.工业上电解熔融氧化物制备G的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com