
| A、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、金属的电化学腐蚀普遍存在,工业上经常用牺牲阳极的阴极保护法对金属进行保护,这是电解原理的一个重要应用 |
| ||
| 4 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期的实验目的或结论 |
| A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质含钠元素 |
| B | 将SO2气体通入某红色溶液中,溶液褪色 | 该溶液一定为品红溶液 |
| C | 蔗糖溶液中加入少量稀硫酸、加热,然后加入银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
| D | 除去苯中混有的少量苯酚 | 加入浓溴水后过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮肥厂用氢气和氮气合成氨 |
| B、纯碱厂用侯氏制碱法制纯碱 |
| C、硫酸厂用接触法生产硫酸 |
| D、氯碱厂用电解饱和食盐水制烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
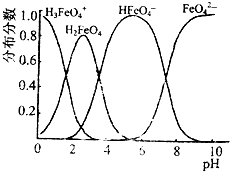 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、乙烯、苯、乙醇和乙酸都能发生加成反应 |
| B、欲将蛋白质从水中析出而又不改变它的性质,可加入CuSO4溶液 |
| C、苯分子中的碳碳化学键是介于碳碳单键和碳碳双键之间的独特的键 |
| D、CH3CH2CH2CH(CH3)2与CH3CH(CH3)C(CH3)3互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在自然界中只以化合态的形式存在 |
| B、RO32-所含电子数比NO3-的电子数多7 |
| C、最高氧化物能与水反应生成含氧酸 |
| D、气态氢化物比CH4稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、常温下,2.3g Na完全与O2反应失去的电子数为0.1NA |
| C、100mL 18.4mol?L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92 NA |
| D、在密闭容器中加入1.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com