
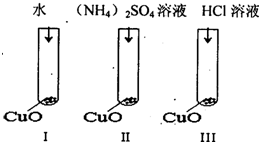


科目:高中化学 来源: 题型:
| A、溶于水后得到的溶液能导电的物质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、KNO3是电解质故KNO3晶体能导电 |
| D、二氧化碳的水溶液能导电,但二氧化碳不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
| l | KClO3 | 400(无气体放出) | 480(有少量气体放出) |
| 2 | KClO3+MnO2 | 350(有大量气体放出) |
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 | 假设l正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 选项的标号 |
| 除去FeCl2溶液中的少量FeCl3 | |
| 除去FeCl3溶液中的少量FeCl2 | |
| 除去SiO2中Al2O3 | |
| 除去Fe2O3中Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
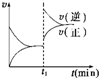 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )| A、2SO2(g)+O2(g)?2SO3(g)△H< |
| B、4 NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、H2(g)+I2(g)?2HI(g)△H>0 |
| D、2 NH3(g)?N2(g)+3H2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
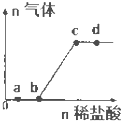 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、OH-、SO42-、NO3- |
| B、b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com