
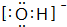
分析 A、B、C、D、E为原子序数依次递增的5种短周期元素,A、B、C同周期,C、E同主族,则A、B、C处于第二周期,E处于第三周期,A原子最外层电子数是次外层电子数的2倍,最外层电子数为4,则A为碳元素;C与氢元素能组成10电子的X-离子,可推知C为O元素、B为N元素,X-离子为OH-;则E为S元素;D单质是生活中常见的一种金属,又处于短周期,故D为Al,据此解答.
解答 解:A、B、C、D、E为原子序数依次递增的5种短周期元素,A、B、C同周期,C、E同主族,则A、B、C处于第二周期,E处于第三周期,A原子最外层电子数是次外层电子数的2倍,最外层电子数为4,则A为碳元素;C与氢元素能组成10电子的X-离子,可推知C为O元素、B为N元素,X-离子为OH-;则E为S元素;D单质是生活中常见的一种金属,又处于短周期,故D为Al.
(1)CO2分子中碳原子与氧原子之间形成2对共用电子对,其结构式为O=C=O,
故答案为:O=C=O;
(2)X-离子为OH-,电子式为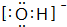 ,故答案为:
,故答案为: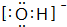 ;
;
(3)D为Al元素,的某种化合物可用于净水,该化合物为明矾,溶液中铝离子水解:Al3++3H2O=Al(OH)3(胶体)+3H+,得到氢氧化铝胶体,可以吸附水中悬浮物质,起净水作用,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+;
(4)将SO2气体通入BaCl2与硝酸稀溶液的混合液中,硝酸将二氧化硫氧化为硫酸,硝酸钡还原为NO,硫酸与氯化钡反应生成硫酸钡沉淀,其反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意对基础知识的理解掌握.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基的电子式是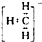 | B. | 硫的原子结构示意图是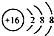 | ||
| C. | ${\;}_{8}^{18}$O表示中子数是18的氧原子 | D. | 过氧化氢的结构式是H-O-O-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
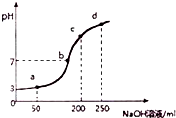 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )| A. | a、b、c、d四个点,水的电离程度最大的是a | |
| B. | b点溶液中存在c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 在0.1mol?L-1NH4Al(SO4)2溶液中:c(NH4+)+3c(Al3+)=0.199 mol?L-1 | |
| D. | 滴加NaOH溶液期间,溶液中NH4+与SO42-浓度之和始终为0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2 和NH3 | C. | NO和CO2 | D. | NO2 和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 实验室制乙烯时温度计水银球在反应液中 | |
| D. | 检验溴乙烷中的溴元素时,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,滴加AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com