
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4% 反应开始前先通N2一段时间,反应完成后继续通N2一段时间;在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管
2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4% 反应开始前先通N2一段时间,反应完成后继续通N2一段时间;在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管
【解析】
(1)①②用H2还原无水FeCl3制取无水FeCl2,B装置用锌和稀盐酸制备H2,A装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以盛放碱石灰,D装置H2还原FeCl3,再用C装置吸收反应产生的HCl,最后用E点燃处理未反应的氢气;
③该制备装置的缺点为FeCl3固体易升华,蒸气遇冷发生凝华分析;
(2)①根据仪器结构判断其名称;
②三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2等,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后得到粗产品,根据物质的熔沸点和溶解性可知,可以用苯洗涤;根据滤液中各种物质沸点的不同对滤液进行蒸馏可回收C6H5Cl,据此答题;
③根据消耗的NaOH计算反应生成的HCl,结合方程式2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑计算转化的FeCl3,最终计算FeCl3的转化率;
④FeCl3、FeCl2易吸水,反应产生的HCl会在容器内滞留。
(1)①H2具有还原性,可以还原无水FeCl3制取FeCl2,同时产生HCl,反应的化学方程式为H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
②用H2还原无水FeCl3制取无水FeCl2,装置连接顺序:首先是使用B装置,用锌和稀盐酸制备H2,所制H2中混有HCl和H2O(g),再用A装置用来除去氢气中的氯化氢,然后用C装置干燥氢气,C装置中盛放碱石灰,再使用D装置使H2还原FeCl3,反应产生的HCl气体用C装置的碱石灰来吸收,未反应的H2通过装置E点燃处理,故按照气流从左到右的顺序为BACDCE;也可以先使用B装置制取H2,然后通过C的碱石灰除去氢气中的杂质HCl、水蒸气,然后通过D发生化学反应制取FeCl2,再用碱石灰吸收反应产生的HCl,最后通过点燃处理未反应的H2,故按照装置使用的先后顺序也可以是BCDCE;
C中盛放的试剂是碱石灰,是碱性干燥剂,可以吸收HCl或水蒸气;
③该制备装置的缺点为FeCl3固体易升华,蒸气遇冷发生凝华,导致导气管发生堵塞;
(2)①根据图示装置中仪器a的结构可知该仪器名称为球形冷凝管;
②三颈瓶内物质为氯化亚铁、C6H5Cl、C6H4Cl2等,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后得到粗产品,根据物质的熔沸点和溶解性可知,C6H5Cl、C6H4Cl2容易溶解在苯、乙醇中,不溶于水,而FeCl3、FeCl2易溶于水、乙醇,难溶于苯,所以洗涤时洗涤剂用苯;根据滤液中C6H5Cl、C6H4Cl2这两种物质沸点的不同,对滤液进行蒸馏,并收集沸点132℃的馏分,可回收C6H5Cl;
③n(HCl)=n(NaOH)=0.40mol/L×0.0196L×![]() =0.0784mol,根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,反应的FeCl3的物质的量为n(FeCl3)反应=2n(HCl)= 0.0784mol×2=0.1568mol,n(FeCl3)总=32.5g÷162.5g/mol=0.2mol,所以氯化铁转化率为
=0.0784mol,根据反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,反应的FeCl3的物质的量为n(FeCl3)反应=2n(HCl)= 0.0784mol×2=0.1568mol,n(FeCl3)总=32.5g÷162.5g/mol=0.2mol,所以氯化铁转化率为![]() ×100%=78.4%;
×100%=78.4%;
④FeCl3、FeCl2易吸水,为防止B装置中的水蒸气进入A装置,导致FeCl2等吸水而变质,可以在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管;同时为防止FeCl3、FeCl2与装置内空气中的水蒸气、O2等反应,同时避免反应产生的HCl气体会在容器内滞留,可以反应开始前先通N2一段时间排尽装置中空气,反应完成后继续通N2一段时间将反应生成的HCl全部排入锥形瓶中。


科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:反应Ⅰ中所有金属元素均以离子形式存在。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应还原产物的化学式____。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(3)反应Ⅲ中X可以是______。(填字母代号)它的作用是______。
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阴极电极反应式_______________。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH__7(填“>”“=”或“<”),理由是____。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=_____。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是冶炼金属铝的重要原料,其中主要成分为 Al2O3、Fe2O3 等。工业上可 NaOH 溶解 Al2O3 使 其与杂质分离:Al2O3+2NaOH═2NaAlO2+H2O
(1)找出上述反应中化合价为负值的元素,写出其原子的电子式_____。
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为_____。
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为:____,从原子结构的角度分 析其原因:_________。
(4)若根据化学性质进行物质分类,则 Al2O3 属于______氧化物,据此推测下列反应方程式正确的是______。
A.Al2O3+3H2O═2Al(OH)3
B.2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O
C.Al(OH)3+NaOH═NaA1O2+2H2O
D NaAlO2+4HCl═AlCl3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明As2O3在医药领域有重要应用。某小组从工业废料中提取As2O3设计流程如下:

已知:H3AsO3为弱酸,热稳定性差。
(1)写出一条“碱浸”时提高浸取率的方法____;“碱浸”中H3AsO3转化成Na3AsO3的离子方程式为____。
(2)“氧化”时常在向混合液中通入O2时对体系加压,目的是____。
(3)“沉砷”过程中有如下反应:
①![]()
![]() <0
<0
②![]()
![]() >0
>0
沉砷率与温度关系如图。沉砷最佳温度为____,高于85℃时,沉砷率下降的原因是____。

(4)“还原”过程中获得H3 AsO3的化学反应方程式为____;“操作A”为:____、过滤;滤液Ⅱ的主要成分是____。
(5)若每步均完全反应,“氧化’’和“还原”时消耗相同条件下O2和SO2体积分别为xL、yL,则废水中n(H3AsO3):n(H3AsO4)=____(写出含x、y的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间发生如下的转化:
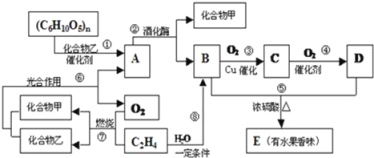
(1)写出D分子中官能团的名称:_____,C物质的结构简式:____.
(2)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是__________.
(3)请写出下列转化的化学反应方程式:
①(C6H10O5)n→A:_____; ②乙烯生成聚乙烯:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼具有高强度、高熔点、耐磨抗腐性,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO42H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
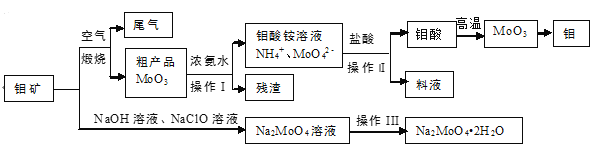
(1)Na2MoO42H2O中钼元素的价态为___,煅烧产生的尾气引起的环境危害主要是_______。
(2)用浓氨水溶解粗产品的离子方程式是_________,由图中信息可以判断MoO3是___氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作I是_____,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____。
(4)采用 NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。
①请配平以下化学反应:
___NaClO +___MoS2 + ___NaOH →___Na2MoO4 +___Na2SO4 +___NaCl +___H2O。
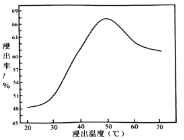
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是______(写一点)。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
Lix(MoS2)n,则电池充电时阳极上的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H—H | Cl—Cl | O===O | C—Cl | C—H | O—H | H—Cl |
E/kJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
请回答下列问题:
如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=______________(用含有a、b的关系式表示)。

若图示中表示反应 H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________kJ·mol-1,x=__________。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为___________________________________。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的能量变化为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com