
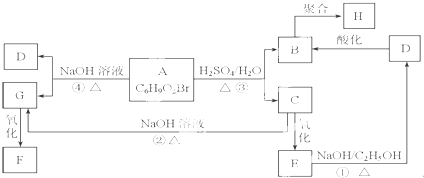
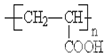 ;
;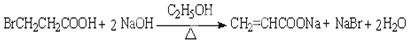
分析 A中不饱和度=$\frac{6×2+2-10}{2}$=2,A能发生水解反应说明含有酯基,根据其不饱和度知,A中还含有碳碳双键,A水解生成B、C,C能发生氧化反应,则C中含有醇羟基,B为羧酸,C氧化得E,E在氢氧化钠醇溶液中发生消去反应得D,D的分子式为C3H3O2Na,D酸化得B,则B、C中碳原子个数相等为3,E能和氢氧化钠的醇溶液发生消去反应,则C、E中含有-Br,D酸化得到B,所以B、D中含有碳碳双键,则B为CH2=CHCOOH、D为CH2=CHCOONa,B发生加聚反应生成 H为,A和氢氧化钠的水溶液发生水解反应生成D和G,G能发生氧化反应生成F,G为醇,且含有两个醇羟基,0.1mol F还能与足量NaHCO3反应,在标准状况下放出4.48L CO2,说明F中含有两个羧基,5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,所以F的摩尔质量为$\frac{5.2g}{0.05mol}$=104g•mol-1,则F结构简式为HOOCCH2COOH,根据转化关系可知,G结构简式为HOCH2CH2COOH,C为BrCH2CH2CH2OH,E为BrCH2CH2COOH,A为CH2=CHCOOCH2CH2CH2Br,此分析解答.
解答 解:A中不饱和度=$\frac{6×2+2-10}{2}$=2,A能发生水解反应说明含有酯基,根据其不饱和度知,A中还含有碳碳双键,A水解生成B、C,C能发生氧化反应,则C中含有醇羟基,B为羧酸,C氧化得E,E在氢氧化钠醇溶液中发生消去反应得D,D的分子式为C3H3O2Na,D酸化得B,则B、C中碳原子个数相等为3,E能和氢氧化钠的醇溶液发生消去反应,则C、E中含有-Br,D酸化得到B,所以B、D中含有碳碳双键,则B为CH2=CHCOOH、D为CH2=CHCOONa,B发生加聚反应生成 H为,A和氢氧化钠的水溶液发生水解反应生成D和G,G能发生氧化反应生成F,G为醇,且含有两个醇羟基,0.1mol F还能与足量NaHCO3反应,在标准状况下放出4.48L CO2,说明F中含有两个羧基,5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,所以F的摩尔质量为$\frac{5.2g}{0.05mol}$=104g•mol-1,则F结构简式为HOOCCH2COOH,根据转化关系可知,G结构简式为HOCH2CH2COOH,C为BrCH2CH2CH2OH,E为BrCH2CH2COOH,A为CH2=CHCOOCH2CH2CH2Br,
(1)通过以上分析知,C为BrCH2CH2CH2OH,C中的官能团的名称为溴原子、羟基,
故答案为:溴原子、羟基;
(2)通过以上分析知,F、H结构简式分别是HOOCCH2COOH、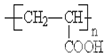 ,故答案为:HOOCCH2COOH、
,故答案为:HOOCCH2COOH、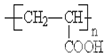 ;
;
(3)①④分别是消去反应、取代或水解反应,
故答案为:消去反应;取代(水解)反应;
(4)反应①的化学方程式为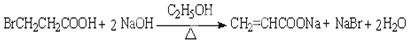 ,
,
故答案为: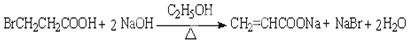 ;
;
(5)B为CH2=CHCOOH,相对分子质量比B大14,且与B具有相同官能团的物质的结构简式为CH2=CHCH2COOH、CH3CH2=CHCOOH、CH2=C(CH3)COOH,
故答案为:CH2=CHCH2COOH或CH3CH2=CHCOOH或CH2=C(CH3)COOH.
点评 本题考查有机物推断,侧重考查学生分析判断能力,涉及卤代烃、醇、羧酸、烯烃之间的转化,正确判断溴原子位置是解本题关键,注意有机物发生消去反应时结构特点,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
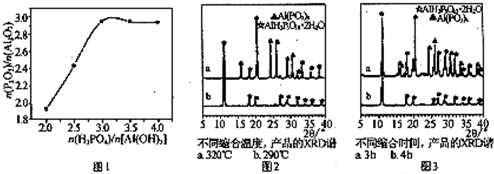
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
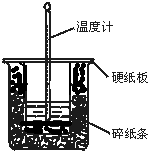 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
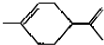 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为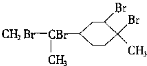 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S区、第五周期、ⅠA族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com