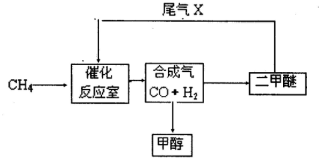
��2010?�Ϸ���ģ���ϳ�����CO+H
2����һ����Ҫ�Ļ���ԭ�ϣ��ڻ��������о���ʮ�ֹ㷺����;�� ������������Ϊ21���͵�����ȼ��--�״��������ѣ�CH
3OCH
3�������ʣ��乤���������£�
��1��д���úϳ������������ѵĻ�ѧ����ʽ
��
��2��β��ѭ�����漰�����·�Ӧ��CH
4��g��+H
2O��g��?CO��g��+3H
2��g������д��ij�¶��¸÷�Ӧ��ƽ�ⳣ������ʽ
K=| c(CO)?c3(H2) |
| c(H2O)?c(CH4) |
K=| c(CO)?c3(H2) |
| c(H2O)?c(CH4) |
��
��3����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H
2��g��?CH
3OH��g����H
1��Ӧ��CO
2��g��+3H
2��g��?CH
3��g��+H
2O��g����H
2���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
�ɱ��������жϡ�H
1��
��
0�����������=��������������
���Ѻͣ�CH
3OH��g��+
O
2��g���TCO
2��g��+2H
2��g����H
3=-192.9kJ?mol
-1H
2��g��+
O
2��g���TH
2O��g����H
4=-241.8kJ?mol
-1���H
2=
-48.9kJ?mol-1
-48.9kJ?mol-1
��
��4���Զ����ѡ�����������������ҺΪԭ�ϣ���Ϊ�缫����ȼ�ϵ�أ�д���õ�ظ����ĵ缫��Ӧʽ
CH3OCH3+160H--12e-�T2CO32-+11H2O
CH3OCH3+160H--12e-�T2CO32-+11H2O
��

 ��2010?�Ϸ���ģ���ϳ�����CO+H2����һ����Ҫ�Ļ���ԭ�ϣ��ڻ��������о���ʮ�ֹ㷺����;�� ������������Ϊ21���͵�����ȼ��--�״��������ѣ�CH3OCH3�������ʣ��乤���������£�
��2010?�Ϸ���ģ���ϳ�����CO+H2����һ����Ҫ�Ļ���ԭ�ϣ��ڻ��������о���ʮ�ֹ㷺����;�� ������������Ϊ21���͵�����ȼ��--�״��������ѣ�CH3OCH3�������ʣ��乤���������£�

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
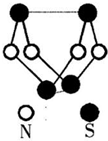 ��2010?�Ϸ���ģ���ִ�����ѧ����һ����������о�����Ϊ��Ծ������֮һ������ͼ���Ѿ��ϳɵ�����������һ��������ķ��ӽṹ������˵��������ǣ�������
��2010?�Ϸ���ģ���ִ�����ѧ����һ����������о�����Ϊ��Ծ������֮һ������ͼ���Ѿ��ϳɵ�����������һ��������ķ��ӽṹ������˵��������ǣ�������
 ��2010?�Ϸ���ģ����һ�ܱ������г���4mol SO2��һ����O2��������Ӧ��2SO2��g��+O2��g��?2SO3��g����H=һ196.6kJ?mol-1��������˵����ȷ���ǣ�������
��2010?�Ϸ���ģ����һ�ܱ������г���4mol SO2��һ����O2��������Ӧ��2SO2��g��+O2��g��?2SO3��g����H=һ196.6kJ?mol-1��������˵����ȷ���ǣ�������