
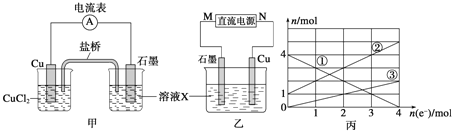
【题目】如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 “AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
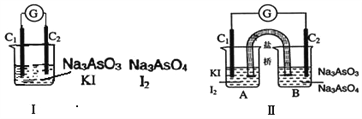
A. 甲组操作时,微安表(G)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2做正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 氯化钠的电子式:![]() B. 氯原子的结构示意图:
B. 氯原子的结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 质子数为35、中子数为45的溴原子: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学试剂的保存方法不正确的是
A.金属钠保存在煤油中B.氯水保存在棕色瓶中
C.氢氟酸保存在塑料瓶中D.NaOH溶液保存在带玻璃塞的细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
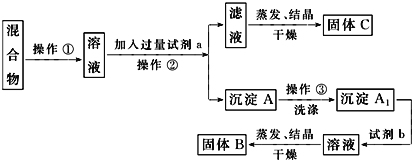
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)试剂a是_________,加入试剂b所发生反应的离子方程式为_________。
(2)该方案能否达到实验目的_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
(3)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外至少还要获得的数据是____的质量。
(4)用所(3)所制备的KCl固体配制0.1mol/LKCl溶液450mL,回答下列问题:
(i)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、____________。
(ii)需要用托盘天平称量______________gKCl固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
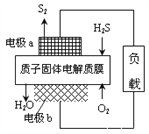
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若要完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3的体积比为1:1:1,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向氨水溶液中通入CO2,各种离子的变化趋势如下图所示。下列说法正确的是
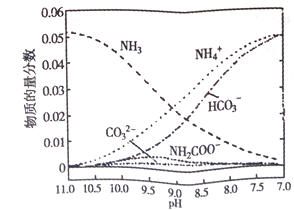
A. 随着CO2的通入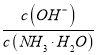 不断增大
不断增大
B. 在pH=9.0时,c(NH4+)>c(CO32-)><(HCO3-)>c(NH2CO0O-)
C. 溶液中: c(NH4+)+c(NH3)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示.该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________。

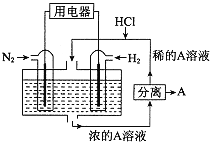
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________________________,A是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种酸与锌片反应,起始时生成H2反应速率最大的是
A. 10 ℃ 20 mL 3 mol/L的盐酸 B. 10 ℃ 40 mL 2 mol/L的醋酸
C. 20 ℃ 20 mL 2 mol/L的硫酸 D. 20 ℃ 10 mL 4 mol/L的硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com