
【题目】含有相同硫原子数的SO2和SO3,其分子的质量比为( )
A. 6∶5 B. 1∶1 C. 4∶5 D. 2∶1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A. 黑色固体是碳
B. 钠在燃烧时只发生了一个反应
C. 钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO2![]() 2MgO+C)
2MgO+C)
D. 钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为;
(2)第一电离能:S(填“>”“<”或“=”,下同)P;电负性:SP.
(3)三硫化四磷分子中P原子采取杂化,与PO3﹣互为等电子体的化合物分子的化学式为 .
(4)二硫化碳属于(填“极性”或“非极性”)分子.
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为 .
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH﹣之间的距离为acm,晶胞中Na+的配位数为 , 用NA表示阿伏加德罗常数的数值,NaOH的密度为 gcm﹣3 . 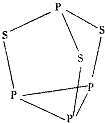
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等.用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图1: 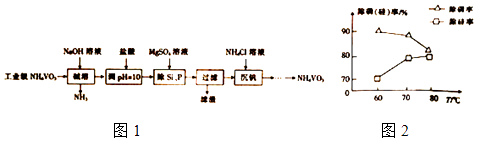
(1)碱溶时,下列措施有利于NH3逸出的是(填字母). a、升高温度 b、增大压吸 c、增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3 , 已知Ksp(MgSiO3)=2.4×l0﹣5 . 若滤液中c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ②由图2可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和;但随着温度的升高,除硅率升高,其原因是(用离子方程式表示).
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率.加入蒸馏水的目的是
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

请回答下列问题:
(1)写出化学式:A________。
(2)写出下列反应的离子方程式:
A→B___________________________________。
B→D_________________________________。
C→E_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素为无色、细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,最终导致死亡。该外毒素为环状肽,结构式如图所示。

请据图分析回答下面的问题。
(1)该化合物中含有________个游离的氨基,________个游离的羧基。
(2)组成该化合物的氨基酸有_______种,其中重复出现的R基是_______________,请写出氨基酸的结构通式:____________________________。
(3)该化合物含有________个肽键。
(4)b框所示的R基所构成的氨基酸的相对分子质量是________。
(5)该外毒素在环状肽形成过程中失去了________个水分子,相对分子质量减少了________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+ . 用K2Cr2O7溶液进行下列实验: 
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72﹣被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO(g)+Cl2(g)2ClNO(g)△H<0
写出该反应的平衡常数表达式 .
为研究不同条件对反应的影响,:在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应达到平衡.测得10min内v(ClNO)=7.5×10﹣3 molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K(填“增大”“减小”或“不变”).若要使K减小,可采取的措施是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com