
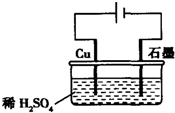
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断增大 |
分析 由图中装置可知,装置是电解池,铜和电源正极连接座电解池阳极,铜本身失电子生成铜离子;石墨解电源负极做电解池的阴极,溶液中氢离子得到电子生成氢气;溶液中铜离子和氢氧根离子结合生成氢氧化铜沉淀.
解答 解:A、电解过程中,铜电极是活性电极,铜失电子生成铜离子,故A错误;
B、电解初期,阳极电极反应为Cu-2e-=Cu2+;阴极电极反应为:2H++2e-=H2↑,所以反应初期发生的反应为Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑,故B正确;
C、电解一定时间后,溶液中铜离子移向阴极优先放电生成铜,所以电解一定时间后,石墨电极上有铜析出,故C正确;
D、电解过程中氢离子不断放电生成氢气,浓度减小,故D错误;
故选BC.
点评 本题考查了电解原理的原理应用,电极反应,电极判断,电极名称是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 某研究小组探究:
某研究小组探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
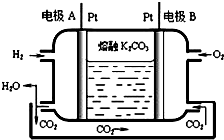 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
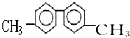
| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: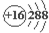 | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: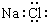 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +HCl
+HCl

 (其中两种)
(其中两种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com