


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z |
| 甲 | 乙 | 丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
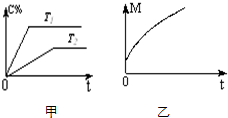 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶液中加入过量的氨水A13++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH十HCO3-=CH3COO-+CO2↑+H2O |
| C、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- |
| D、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com