
分析 ①该化合物中O元素为-2价、H元素化合价为+1价,根据化合物中各元素化合价的代数和为0确定Ni元素化合价;
②充电时电池反应式与放电时电池反应式正好相反,充电总反应为:M+Ni(0H)2=MH+NiOOH,则放电总反应为MH+NiOOH=M+Ni(0H)2,放电时,负极上MH失电子发生氧化反应,正极上Ni(0H)2得电子发生还原反应.
解答 解:①该化合物中O元素为-2价、H元素化合价为+1价,根据化合物中各元素化合价的代数和为0确定Ni元素化合价为+3,故答案为:+3;
②充电时电池反应式与放电时电池反应式正好相反,充电总反应为:M+Ni(0H)2=MH+NiOOH,则放电总反应为MH+NiOOH=M+Ni(0H)2,放电时,负极上MH失电子发生氧化反应,电极反应式为MH+OH--e-═M+H2O,正极上Ni(0H)2得电子发生还原反应,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,
故答案为:MH+OH--e-═M+H2O;NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查化学电源新型电池,为高频考点,明确原电池和电解池反应式关系是解本题关键,会根据元素化合价变化确定正负极、阴阳极发生的反应,难点是电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池属于二次电池 | |
| B. | 锂离子电池是一种一次性电池 | |
| C. | 氢氧燃料电池可把化学能转化为电能 | |
| D. | 镍镉电池中,Cd为负极,NiO(OH)为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强 | |
| B. | 为了消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以单质的形式存在 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保险要求 | |
| D. | 苯酚有杀菌和止痛作用,药皂中也掺有少量苯酚,所以可以用苯酚对环境消毒或直接涂抹于皮肤上进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
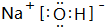 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向碳酸钠溶液中滴入酚酞试液,加热 | 溶液红色加深 | 碳酸钠水解吸热 |
| B | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| C | 向Fe(NO3)2溶液中先滴入KSCN溶液再滴加盐酸 | 加入盐酸后溶液变成血红色 | Fe2+被盐酸氧化为Fe3+ |
| D | 向1mL0.1mol/LMgSO4溶液中滴入10mL等浓度的NaOH溶液,片刻后再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的溶度积常数比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
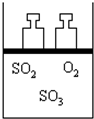 如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com