
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
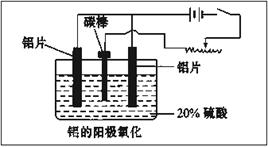
(3)下列说法正确的是 。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
【知识点】本题考查电解原理;金属冶炼的一般原理
【答案】(1)Al-3e-═Al3+, D;(2)2Al+3H2O-6e-═Al2O3+6H+,(3)BD
解析(1)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-═Al3+,电解精炼铝应以纯铝作阴极材料,故答案为:Al-3e-═Al3+;D;(2)根据阳极发生氧化反应可以得到电极反应式为:2Al+3H2O-6e-═Al2O3+6H+,
故答案为:2Al-6e-+3H2O═Al2O3+6H+;(3)A.阳极氧化应用的是电解原理,故A错误; B.由于氧化物的生成可以增强铝表面的绝缘性,故B正确; C.铝的阳极氧化可以提高铝及铝合金的耐腐蚀性,但耐磨性不下降,故C错误; D.氧化铝具有不同的晶型,其中的δ-Al2O3具有多孔性、强吸附性和催化活性,可做吸附剂和催化剂,故D正确.故答案为:BD.
【思路点拨】本题考查综合考查电化学知识,侧重于电解的原理和考查与应用,为高考常见题型和高频考点,注意把握电极方程式的书写,难度中等


科目:高中化学 来源: 题型:
下列有关推断正确的是( )
A.SO3 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.酸酐一定是氧化物, 金属氧化物一定是碱性氧化物
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
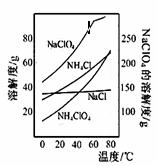
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如下图),其实验流程如下:
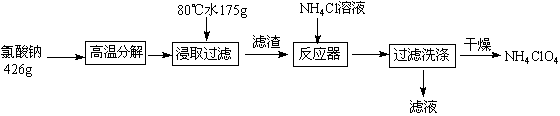
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为 (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 。
(4)已知:2NH4ClO4  N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
N2↑+ 2O2↑ + Cl2↑ +4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。
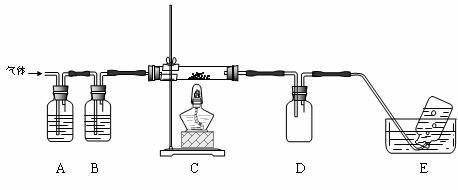
① E中收集到的气体可能是 (填化学式) 。
②装置D的作用可能是 。
③ A、B、C中盛放的药品依次可以是 (选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ.a b d Ⅱ.c b e Ⅲ.b c f
查看答案和解析>>
科目:高中化学 来源: 题型:
某Na2CO3、NaAlO2的混合溶液中逐滴
加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因
B.CH4、NH3、PH3的热稳定性逐渐增强
C.因为酸性:HC1>HF,所以非金属性:Cl>F
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱
查看答案和解析>>
科目:高中化学 来源: 题型:
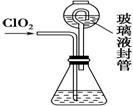
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与
还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
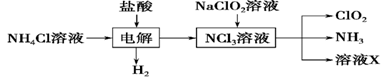
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O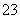 = 2I-+S4O
= 2I-+S4O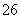 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO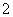 。
。
2001年我国卫生部规定,饮用水的ClO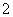 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO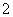 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为短周期的一部分,Y原子最外层电子数
是其电子层数的2倍,下列说法正确的是( )
A.Y的氢化物比Z的氢化物稳定
B.原子半径大小顺序是X >Y>R
C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物的酸性最强的是Y

查看答案和解析>>
科目:高中化学 来源: 题型:
按以下装置图进行实验,填写有关现象及化学方程式。
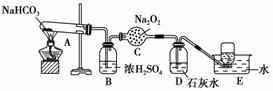
(1)A中现象是_______________________________________,
(2)B中浓硫酸的作用是__________________________________________,
(3)C中发生反应的化学方程式为________________________________________,
(4)D中现象是______________________________________________,
离子方程式是__________________________________________________________,
(5)E中收集的气体是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com