
| A. | HCl | B. | NH4Cl | C. | CH3COONa | D. | NaHCO3 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
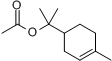 |
| 乙酸松油酯的结构式 |
| A. | 松油醇的分子式为C10H16O | |
| B. | 乙酸松油酯在NaOH溶液加热条件下得到的醋酸钠和松油醇 | |
| C. | 乙酸松油酯能发生加聚反应 | |
| D. | 乙酸松油酯能发生加成反应也能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
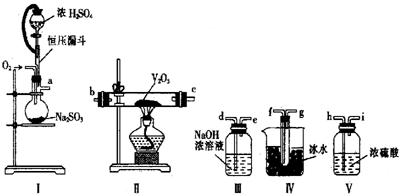
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
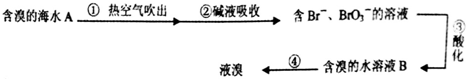
| A. | ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- | |
| B. | 第③步,需加人氧化性酸,才能将Br-氧化为Br2 | |
| C. | B溶液颜色要比A 溶液深 | |
| D. | 第④步,采用的是蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
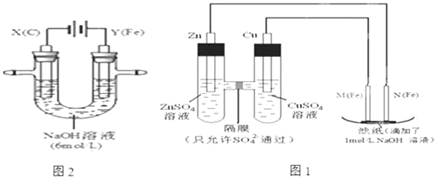
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无法判断混合物中是否含有Na2O | B. | 由Ⅱ可知X中一定存在SiO2 | ||
| C. | 1.92g固体成分为Cu | D. | 15.6g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com