
| A、二氧化硫具有漂白和杀菌性能,可在食品加工业中大量使用 | B、自来水厂常用绿矾和Cl2对水进行处理 | C、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | D、氢氟酸由于具有强酸性,可用于雕刻玻璃 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫具有漂白和杀菌性能,可在食品加工业中大量使用 | B、人体不能消化纤维素,所以饮食时不需要吃膳食纤维含量高的食品 | C、碳酸钠溶液显碱性,可用热的纯碱溶液洗涤餐具上的油污 | D、食盐可以融冰化雪,用食盐作融雪剂不会对环境产生危害 |
查看答案和解析>>
科目:高中化学 来源:2012届浙江省绍兴一中高三上学期期中考试化学试卷 题型:填空题
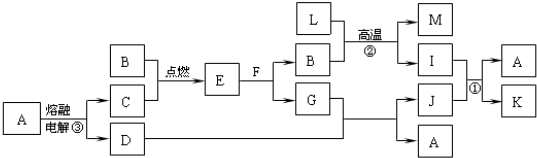
下图是中学化学中常见的一些单质或化合物之间的转化关系图,其中部分反应中涉及到的水未列出。已知A、B、F是人类生存或日常生活中必不可少的物质,I、J均具有漂白性,但两者混合后的产物均不具有漂白性。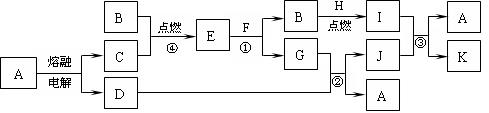
请回答下列问题:
⑴ A的晶体类型为 ,E的电子式为 ;
⑵写出下列反应的离子方程式:反应① ,
反应③ 。
⑶若反应④中1mol物质C完全反应放出a kJ的热量,写出反应④的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com