
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
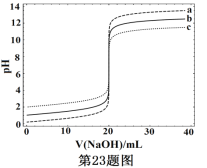
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是

A.反应中氧化剂和还原剂的物质的量之比为2∶3
B.装置D中液体可以使干燥的红色石蕊试纸变蓝
C.装置B中加入的物质可以是碱石灰或无水氯化钙
D.为防止装置D中发生倒吸,可以改用向下排空气法收集氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)![]() CaO(s) + CO2(g) △H1= +178.30kJ/mol
CaO(s) + CO2(g) △H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)![]() CaSO4(s) △H2= -501.92 kJ/mol
CaSO4(s) △H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g) ![]() CO2(g) △H3
CO2(g) △H3
④CaSO4(s) + CO(g) ![]() CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
CaO(s) + SO2(g) + CO2(g) △H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数________(填“增大”“减小”或“不变”)。
(2)△H3=________kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
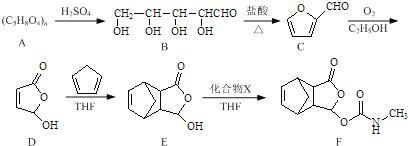
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物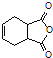 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)= CO2(g)+2H2O(l)ΔH=-Q1kJ/mol;
2H2(g)+O2(g)= 2H2O(g)ΔH =-Q2kJ/mol ;
2H2(g)+O2(g)= 2H2O(l)ΔH =-Q3kJ/mol。取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为
A.4Q1+0.5Q3B.4Q1+0.5Q2C.4Q1+Q3D.4Q1+2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,每个编号代表一种元素,请根据要求回答问题:
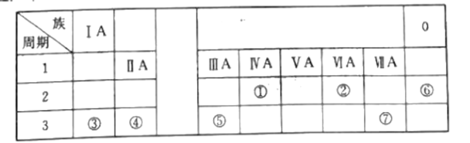
(1)表中金属性最强的元素为___(填元素符号);
(2)最稳定的元素为___(填元素符号);
(3)③、⑦的原子半径大小关系:③___(填“>”“<”或“=”)⑦);
(4)④和⑦两种元素组成的化合物与AgNO3溶液反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:
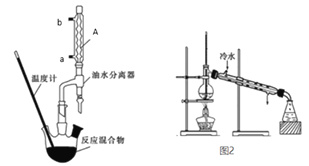
Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2d/s。反应时苯-乙醇-水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)仪器A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图2装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05g·cm3)。实验的产率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com