

【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O=2Cr2O42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是___。
②C的作用是___。
③反应结束后,依然要通一段时间的氮气的原因是___。
④加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量的变化分别为200g、1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为 2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H滴定时,1mo1(CH2)N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL2.000 mo1L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去的NaOH标准溶液的体积___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___。
【答案】固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色 U型干燥管 防止D中水蒸气进入B中,干扰测量生成水蒸气的质量 将A中分解产生的气体全部赶入B中,防止产生实验误差 (NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O 偏大 10.00%
Cr2O3+N2↑+4H2O 偏大 10.00%
![]() 在试管中加入少量
在试管中加入少量![]() 固体,滴加足量浓KOH溶液,振荡、微热,已知:
固体,滴加足量浓KOH溶液,振荡、微热,已知:![]() 橙色
橙色![]() 黄色
黄色![]() 碱溶液中平衡正向进行,溶液显黄色,观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色,
碱溶液中平衡正向进行,溶液显黄色,观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色,
故答案为:固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
![]() 仪器B的名称为U型干燥管,
仪器B的名称为U型干燥管,
故答案为:U型干燥管;
![]() 的作用是防止D中水蒸气进入B中,干扰测量生成水蒸气的质量,
的作用是防止D中水蒸气进入B中,干扰测量生成水蒸气的质量,
故答案为:防止D中水蒸气进入B中,干扰测量生成水蒸气的质量;
![]() 反应结束后,依然要通一段时间的氮气的原因是:将A中分解产生的气体全部赶入B中,防止产生实验误差,
反应结束后,依然要通一段时间的氮气的原因是:将A中分解产生的气体全部赶入B中,防止产生实验误差,
故答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
![]() 摩尔质量为
摩尔质量为![]() 的分解产物,在A中加入
的分解产物,在A中加入![]() 样品,物质的量为
样品,物质的量为![]() ,加热A至恒重,观察到D中溶液不变色,说明无氨气体生成,生成的是氮气,时测得A、B中质量的变化分别为200g、
,加热A至恒重,观察到D中溶液不变色,说明无氨气体生成,生成的是氮气,时测得A、B中质量的变化分别为200g、![]() ,A中残留物为
,A中残留物为![]() ,其物质的量为B中质量的变化为
,其物质的量为B中质量的变化为![]() ,为吸收的水蒸气物质的量为
,为吸收的水蒸气物质的量为![]() ,由质量守恒定律可知化学方程式为
,由质量守恒定律可知化学方程式为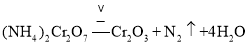 ,
,
故答案为: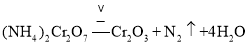 ;
;
![]() 碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,测定结果偏高,
碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,测定结果偏高,
故答案为:偏大;
![]() 反应原理为
反应原理为![]() 、
、![]() 滴定时,
滴定时,![]() 与
与![]() 相当
相当![]() ,然后用NaOH标准溶液滴定反应生成的酸,设
,然后用NaOH标准溶液滴定反应生成的酸,设![]() 的样品物质的量为x,则沉淀
的样品物质的量为x,则沉淀![]() 生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于
生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于![]() 反应生成
反应生成![]() ,用
,用![]() 标准溶液滴定至终点,重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为
标准溶液滴定至终点,重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为![]() ,
,
则![]() ,解得
,解得![]() ,该样品中氮的质量分数为
,该样品中氮的质量分数为![]() ,
,
故答案为:![]() 。
。
【解析】
![]() 在试管中加入少量
在试管中加入少量![]() 固体,滴加足量浓KOH溶液。一方面,
固体,滴加足量浓KOH溶液。一方面,![]() 橙色
橙色![]() 黄色
黄色![]() 碱溶液中平衡正向进行,溶液显黄色;另一方面,NH4++OH-=NH3↑+H2O,由此得出观察到的主要现象。
碱溶液中平衡正向进行,溶液显黄色;另一方面,NH4++OH-=NH3↑+H2O,由此得出观察到的主要现象。
![]() 仪器B的名称为U型干燥管;
仪器B的名称为U型干燥管;
![]() 的作用是防止D中水蒸气进入B中;
的作用是防止D中水蒸气进入B中;
![]() 反应结束后,装置内滞留一定量的反应生成气体,需将其排出。
反应结束后,装置内滞留一定量的反应生成气体,需将其排出。
![]() 摩尔质量为
摩尔质量为![]() 的分解产物,在A中加入
的分解产物,在A中加入![]() 样品,物质的量为
样品,物质的量为![]() ,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,测得A、B中质量的变化分别为200g、
,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,测得A、B中质量的变化分别为200g、![]() ,可求出A中残留物
,可求出A中残留物![]() 的物质的量,B中质量的变化为
的物质的量,B中质量的变化为![]() ,可求出吸收的水蒸气的物质的量,由质量守恒定律可得出化学方程式。
,可求出吸收的水蒸气的物质的量,由质量守恒定律可得出化学方程式。
![]() 碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,由此分析结果;
碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,由此分析结果;
![]() 反应原理为
反应原理为![]() 、
、![]() 滴定时,
滴定时,![]() 与
与![]() 相当
相当![]() ,然后用NaOH标准溶液滴定反应生成的酸,设
,然后用NaOH标准溶液滴定反应生成的酸,设![]() 的样品物质的量为x,利用H++OH-=H2O的定量关系,建立等量关系式,从而求出该样品中氮的质量分数。
的样品物质的量为x,利用H++OH-=H2O的定量关系,建立等量关系式,从而求出该样品中氮的质量分数。
![]() 在试管中加入少量
在试管中加入少量![]() 固体,滴加足量浓KOH溶液,振荡、微热,已知:
固体,滴加足量浓KOH溶液,振荡、微热,已知:![]() 橙色
橙色![]() 黄色
黄色![]() 碱溶液中平衡正向进行,溶液显黄色,观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色。答案为:固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
碱溶液中平衡正向进行,溶液显黄色,观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色。答案为:固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
![]() 仪器B的名称为U型干燥管;答案为:U型干燥管;
仪器B的名称为U型干燥管;答案为:U型干燥管;
![]() 的作用是防止D中水蒸气进入B中,干扰测量生成水蒸气的质量;答案为:防止D中水蒸气进入B中,干扰测量生成水蒸气的质量;
的作用是防止D中水蒸气进入B中,干扰测量生成水蒸气的质量;答案为:防止D中水蒸气进入B中,干扰测量生成水蒸气的质量;
![]() 反应结束后,依然要通一段时间的氮气的原因是:将A中分解产生的气体全部赶入B中,防止产生实验误差;答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
反应结束后,依然要通一段时间的氮气的原因是:将A中分解产生的气体全部赶入B中,防止产生实验误差;答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
![]() 摩尔质量为
摩尔质量为![]() 的分解产物,在A中加入
的分解产物,在A中加入![]() 样品,物质的量为
样品,物质的量为![]() ,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,测得A、B中质量的变化分别为200g、
,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,测得A、B中质量的变化分别为200g、![]() ,A中残留物为
,A中残留物为![]() ,其物质的量为0.01mol,B中质量的变化为
,其物质的量为0.01mol,B中质量的变化为![]() ,为吸收的水蒸气物质的量为
,为吸收的水蒸气物质的量为![]() ,由质量守恒定律可知化学方程式为
,由质量守恒定律可知化学方程式为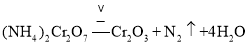 。答案为:
。答案为: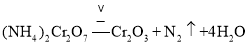 ;
;
![]() 碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,测定结果偏大;答案为:偏大;
碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,相当于稀释,则滴定时用去的NaOH标准溶液的体积偏大,测定结果偏大;答案为:偏大;
![]() 反应原理为
反应原理为![]() 、
、![]() 滴定时,
滴定时,![]() 与
与![]() 相当
相当![]() ,然后用NaOH标准溶液滴定反应生成的酸,设
,然后用NaOH标准溶液滴定反应生成的酸,设![]() 的样品物质的量为x,则沉淀
的样品物质的量为x,则沉淀![]() 生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于
生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于![]() 反应生成
反应生成![]() ,用
,用![]() 标准溶液滴定至终点,重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为
标准溶液滴定至终点,重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为![]() ,则
,则![]() ,解得
,解得![]() ,该样品中氮的质量分数为
,该样品中氮的质量分数为![]() 。答案为:
。答案为:![]() 。
。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某储氢的碳纳米管二次电池的工作原理如图,该电池的电解质为6 mol·L-1的KOH溶液。下列说法正确的是
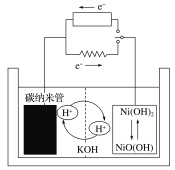
A.放电过程中,碳纳米管的质量一直保持恒重
B.放电时正极附近溶液的pH减小
C.充电时阳极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该二次电池的工作原理为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
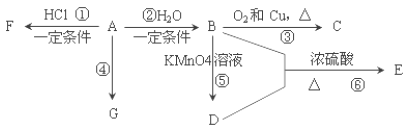
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为 2,2,3-三甲基戊酸
B. 辛酸的羧酸类同分异构体中,含有3个“一CH3”结构,且存在乙基支链的共有7种(不考虑立体异构)
C. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种(不考虑立体异构)
D. 正辛酸常温下呈液态,而软脂酸常温下呈固态,故二者不符合同一通式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 设k为该反应的化学平衡常数,则有k=k逆:k正
B. 达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C. 容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D. 若改变温度为T2,且T2>T1,则k正:k逆<0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )

A.![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B.![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C.![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。下列有关叙述正确的是( )
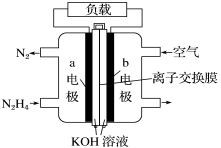
A.该燃料电池放电时,正极发生氧化反应,pH变大
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说祛错误的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.强电解质在液态时,有的导电,有的不导电
C.反应速率常数与浓度无关,但受温度、催化剂、固体表面性质等因素的影响
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com