
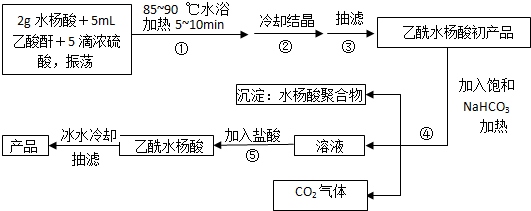
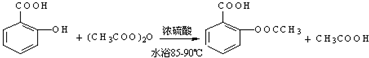
 ;反应类型取代反应;
;反应类型取代反应; 、
、 ;
; ;
;分析 (1)水杨酸和乙酸酐在浓硫酸的条件下发生取代反应生成乙酰水杨酸;
(2)在除去聚合物并提纯阿司匹林的过程中,可以将阿司匹林与碳酸氢钠反应使羧基变成羧钠,且酯基不水解,这样使阿司匹林溶于水,聚合物难溶于水,这样可将聚合物除去,再将阿司匹林的钠盐酸化可得阿司匹林,据此写化学方程式;
(3)阿司匹林中的酯基以及羧基都与NaOH溶液反应;
(4)用冷水洗涤晶体,可以除去晶体表面附着的杂质,并减少阿司匹林因溶解而引起的损耗;
(5)阿司匹林中有羧基能与纯碱溶液能反应、酯基能发生水解反应、苯环能发生加成反应,没有醛基,不能发生银镜反应,没有酚羟基,不能与氯化铁发生显色反应,也不能发生消去反应;
(6)2.000g水杨酸、5.400g乙酸酐反应,理论上可得阿司匹林的产量为$\frac{2}{138}×180$g=2.61g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)水杨酸和乙酸酐在浓硫酸的条件下发生取代反应生成乙酰水杨酸,反应方程式为 ,
,
故答案为: ;取代反应;
;取代反应;
(2)在除去聚合物并提纯阿司匹林的过程中,可以将阿司匹林与碳酸氢钠反应使羧基变成羧钠,且酯基不水解,这样使阿司匹林溶于水,聚合物难溶于水,这样可将聚合物除去,再将阿司匹林的钠盐酸化可得阿司匹林,过程中涉及的离子反应方程式为 、
、 ,
,
故答案为: 、
、 ;
;
(3)阿司匹林中的酯基以及羧基都与NaOH溶液反应,反应的方程式为  ,
,
故答案为: ;
;
(4)用冷水洗涤晶体,可以除去晶体表面附着的杂质,并减少阿司匹林因溶解而引起的损耗,
故答案为:除去晶体表面附着的杂质,并减少阿司匹林因溶解而引起的损耗;
(5)阿司匹林中有羧基能与纯碱溶液能反应,故A正确、酯基能发生水解反应,故D正确、苯环能发生加成反应,故B错误、没有醛基,不能发生银镜反应,故E正确、没有酚羟基,不能与氯化铁发生显色反应,故C错误、也不能发生消去反应,故F错误,
故选ADE;
(6)2.000g水杨酸、5.400g乙酸酐反应,根据方程式 可知,理论上可得阿司匹林的产量为$\frac{2}{138}×180$g=2.61g,阿司匹林的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{1.566g}{2.61g}$×100%=60%,
可知,理论上可得阿司匹林的产量为$\frac{2}{138}×180$g=2.61g,阿司匹林的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{1.566g}{2.61g}$×100%=60%,
故答案为:60%.
点评 本题考查有机物的合成和推断,题目难度中等,本题注意根据物质的性质判断可能含有的官能团,答题时注意灵活运用物质分离提纯的方法.


科目:高中化学 来源: 题型:选择题
| A. | Al元素的第一电离能比Mg元素的大 | |
| B. | 第2周期元素的最高正化合价都等于其原子的最外层电子数 | |
| C. | 同一周期主族元素从左到右,原子半径和离子半径均逐渐减小 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
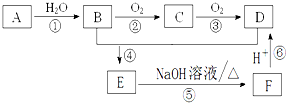 已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:
已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 将1molFeCl3水解制成胶体,所得胶体的微粒数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由黄色变成橙色 | |
| B. | 将二氧化硫通入氯化钡溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 | |
| C. | 向葡萄糖溶液中加入新制氢氧化铜,加热至沸腾,静置后上层溶液呈红色 | |
| D. | 海水提取溴的过程不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 充电电池的化学反应原理是氧化还原反应 | |
| C. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| D. | 质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度一定大于逆反应速度 | B. | 反应物的转化率一定增大 | ||
| C. | 正反应速率一定增大 | D. | 生成物的质量分数一定增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com