氧化还原反应的实质是 ;元素的化合价降低,发生的是 反应;氧化还原反应中,还原剂 电子(填“得”或“失”);试写出Na2O2与H2O反应的化学方程式,并用双线桥标出电子转移的方向和数目: .
【答案】
分析:氧化还原反应的实质是电子转移,化合价降低元素所在的反应物是氧化剂,发生还原反应,元素失去电子化合价升高,化合价升高数=化合价降低数=转移电子数.
解答:解:氧化还原反应的实质是电子转移或电子对偏移,元素的化合价降低,发生的是还原反应,氧化还原反应中,元素失去电子化合价升高,化合价升高元素所在的反应物是还原剂,在Na
2O
2与H
2O的反应中,化合价升高数=化合价降低数=转移电子数=2,电子转移情况为:
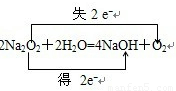
,故答案为:电子的得失或电子对偏移;还原;失;
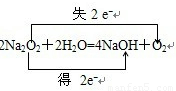
.
点评:本题考查学生氧化还原反应中的基本概念知识,要求学生熟记教材知识,灵活应用.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案