
分析 五种短周期元素A、B、C、D、E的原子序数依次增大,A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,该化合物为氨气,则A是H、B是N元素;
A和C同族,且C原子序数大于B,C离子和B离子具有相同的电子层结构,则C是Na元素;
B和D同族,则D是P元素;
C和E形成的化合物在水中呈中性,则E是Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)A和E形成的化合物是HCl,A和B形成的化合物是氨气,氯化氢和氨气反应生成氯化铵,铵盐中存在离子键和共价键;
(4)D最高价氧化物的水化物是磷酸;
(5)磷在氯气中完全燃烧生成PCl5,不完全燃烧生成PCl3;
(6)单质E是氯气,氯气和水反应生成HCl和HClO,次氯酸是弱酸.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大,A和B、D、E均能形成共价型化合物,A和B形成的化合物在水中呈碱性,该化合物为氨气,则A是H、B是N元素;
A和C同族,且C原子序数大于B,C离子和B离子具有相同的电子层结构,则C是Na元素;
B和D同族,则D是P元素;
C和E形成的化合物在水中呈中性,则E是Cl元素,
(1)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径最大的元素位于周期表左下角,这几种元素中原子半径最大的是Na元素;
同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素,元素非金属性随着原子序数增大而减弱,这几种元素中非金属性最强的是Cl元素;
故答案为:Na;Cl;
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>N>P,所以氢化物的稳定性最差的是PH3,故答案为:PH3;
(3)A和E形成的化合物是HCl,A和B形成的化合物是氨气,氯化氢和氨气反应生成氯化铵,化学式为NH4Cl,铵盐中存在离子键和共价键,所以氯化铵中含有离子键和共价键,A、C形成化合物的电子式为NaH,电子式为Na+[:H]-,
故答案为:NH4Cl;离子键和共价键;Na+[:H]-;
(4)D最高价氧化物的水化物是磷酸,化学式为H3PO4,故答案为:H3PO4;
(5)D为P,在氯气中充分燃烧生成PCl5,方程式为2P+5Cl2$\frac{\underline{\;点燃\;}}{\;}$2PCl5,D在不充足的E中燃烧,生成PCl3,故答案为:2P+5Cl2$\frac{\underline{\;点燃\;}}{\;}$2PCl5;PCl3;
(6)单质E是氯气,氯气和水反应生成HCl和HClO,次氯酸是弱酸,离子方程式为Cl2+H2O═H++Cl-+HClO,故答案为:Cl2+H2O═H++Cl-+HClO.
点评 本题考查位置结构性质相互关系及应用,侧重考查学生推断及知识运用能力,涉及氧化还原反应、元素周期律、化学键等知识点,正确判断元素是解本题关键,注意铵盐中存在的化学键,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同质量的烃,完全燃烧时,含氢元素质量分数越高的烃,消耗O2量越多 | |
| C. | 常温下分子中氢原子数为4的气态烃,与足量O2完全燃烧时,反应前后气体总体积不变 | |
| D. | 烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
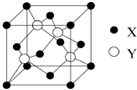 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是有气体参加或生成的化学反应,化学平衡都会受压强的影响 | |
| B. | 增大压强可以使气体分子数增多的可逆反应的正反应速率减小,逆反应速率增大,平衡逆向移动 | |
| C. | 减小压强可以使气体分子数减少的反应逆向移动,同时使正逆反应速率都减小 | |
| D. | 压强对反应前后气体分子数不变的反应的化学平衡和反应速率都没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液和氯化铜溶液 | B. | 硫酸钠溶液和氯化钠溶液 | ||
| C. | 氯化铝溶液和氢氧化钠溶液 | D. | 硫酸氢钠溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 1:4 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com