
在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是( )
|
| A. | pH=3的硝酸跟pH=11的氢氧化钾溶液 |
|
| B. | pH=3的盐酸跟pH=11的氨水 |
|
| C. | pH=3的硫酸跟pH=11的氢氧化钠溶液 |
|
| D. | pH=3的醋酸跟pH=11的氢氧化钡溶液 |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
电离平衡与溶液的pH专题.
分析:
根据酸碱的强弱判断溶液中n(H+)与n(OH﹣)关系进行判断和计算.
解答:
解:A、pH=3的硝酸中c(H+)=1×10﹣3mol/L,pH=11的氢氧化钾溶液中c(OH﹣)=1×10﹣3mol/L,在室温下等体积混合后,pH=7,故A错误;
B、pH=3的盐酸中c(H+)=1×10﹣3mol/L,pH=11的氨水中c(OH﹣)=1×10﹣3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故B错误;
C、pH=3的硫酸中c(H+)=1×10﹣3mol/L,pH=11的氢氧化钠溶液中c(OH﹣)=1×10﹣3mol/L,在室温下等体积混合后,pH=7,故C错误;
D、pH=3的醋酸c(H+)=1×10﹣3mol/L,pH=11的氢氧化钡溶液中c(OH﹣)=1×10﹣3mol/L,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7,故D正确;
故选D.
点评:
本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,注意判断酸碱的强弱并以此判断反应的过量问题.


科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
|
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子,F的最高化合价和最低化合价的代数和为4.R是由B、F两元素形成的离子化合物,其中B+与F2﹣离子数之比为2:1.G位于周期表第6纵行且是六种元素中原子序数最大的.
请回答下列问题:
(1)D元素的电负性 F元素的电负性(填“>”、“<”或“=”).
(2)G的价电子排布图 .
(3)B形成的晶体堆积方式为 ,空间利用率为 区分晶体和非晶体最可靠的科学方法是对固体进行 实验.
(4)D﹣的最外层共有 种不同运动状态的电子,有 种能量不同的电子.F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是 ,F2D2是 分子(填“极性”或“非极性”).
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因 .该分子是极性分子的原因 是 .
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g•cm﹣3.试计算R晶胞的体积是 (阿伏加德罗常数用NA表示,只写出计算式,不用计算)
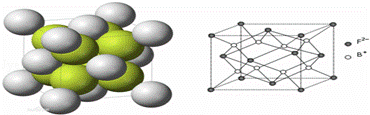
查看答案和解析>>
科目:高中化学 来源: 题型:
对于3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
|
| A. | K= |
|
| B. | K= |
|
| C. | K= |
|
| D. | K= |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中①NaCl溶液、②NaOH、③H2SO4、④Cu、⑤CH3COOH、⑥NH3•H2O、⑦CO2、⑧乙醇、⑨水, 是电解质 是非电解质, 既不是电解质,也不是非电解质.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
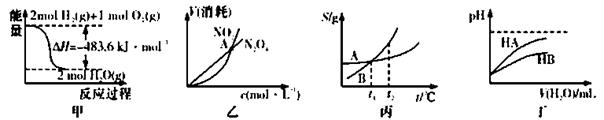
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com