
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
科目:高中化学 来源: 题型:
A.实验室中不能用盐酸来酸化高锰酸钾
B.利用该反应制取氯气时,与用二氧化锰和浓盐酸制氯气实验装置完全相同
C.结合已有知识可以判断氧化性强弱顺序为:![]() >MnO2>Cl2>Fe3+
>MnO2>Cl2>Fe3+
D.该反应中1 mol还原剂失去1 mol电子
查看答案和解析>>
科目:高中化学 来源:2012届江苏省启东中学高三上学期第二次月考化学试卷 题型:实验题
(15分)溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。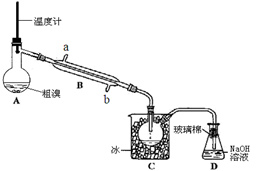

 ①反应过程中需要对A容器加热,加热的方法是 。
①反应过程中需要对A容器加热,加热的方法是 。
图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用如图实验装置精制粗溴。
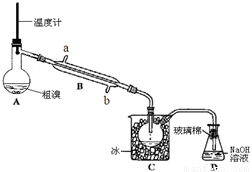
①图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期第二次月考化学试卷 题型:实验题
(15分)溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用下图实验装置精制粗溴。
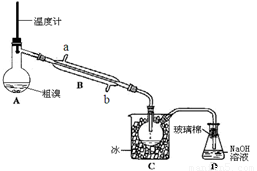
 ①反应过程中需要对A容器加热,加热的方法是
。
①反应过程中需要对A容器加热,加热的方法是
。
图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com