
| A. | 22% | B. | 70% | C. | 66.7% | D. | 33.3% |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
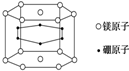
 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
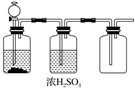
| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯胺的水解产物为NH2OH(羟氨)和HCl | B. | 氯胺的电子式为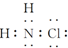 | ||
| C. | 氯胺中氯的化合价为+1价 | D. | 氯胺的消毒原理与漂白粉相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2中含有的分子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1 mol钠原子中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入等物质的量的Cl2:Cl2+2Br-=2 Cl-+Br2 | |
| B. | 4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ | |
| C. | 向NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
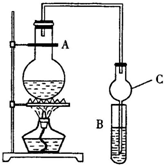 某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液(已知①无水CaCl2可与乙醇形成难溶于的CaCl2•6C2H5OH;②有关有机物的沸点,乙醚:34.7℃;乙醇:78.5℃;乙酸乙酯77.1℃),试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com