
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| X | Y | |||
| W | ||||
| A、Z与Q形成的化合物水溶液不一定显酸性 |
| B、气态氢化物稳定性:Y>W |
| C、Y的单质比W的单质沸点高 |
| D、原子半径从大到小排列是:Z>X>Y>W>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,120g二氧化硅固体中,含有2NA个二氧化硅分子 |
| B、标准状况下,18g重水含有10NA个中子 |
| C、室温下,46克二氧化氮与四氧化二氮混合气体中原子数是3NA |
| D、常温常压下,过氧化钠与过量水反应,生成0.2摩氧气,转移电子0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极上析出5.6mL O2(标准状况) |
| B、阴极上析出64mg Cu |
| C、阴极上析出11.2mL H2(标准状况) |
| D、阳极和阴极质量都无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
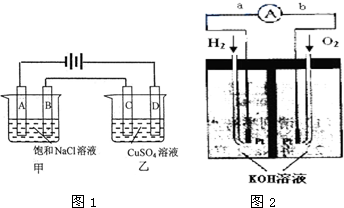 电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:
电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com