
·ÖĪö £Ø1£©µ±1molµŖĘųŗĶ3molĒāĘųĶźČ«·“Ӧɜ³É2mol°±ĘųŹ±£¬·“Ó¦·ÅČČ92.4KJ£»µ«øĆ·“Ó¦ŹĒæÉÄę·“Ó¦£¬Č”1molN2ŗĶ3molH2·ÅŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬²»ÄÜĶźČ«·“Ӧɜ³É2mol°±Ęų£¬¾Ż“Ė·ÖĪö£»
£Ø2£©ĄūÓĆ²īĮæ·Ø¼ĘĖć³öøƶĪŹ±¼äÄŚĻūŗÄĒāĘųµÄĪļÖŹµÄĮæ£¬Č»ŗó¼ĘĖć³öĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹ¼°×Ŗ»ÆĀŹ£®
½ā“š ½ā£ŗ£Ø1£©1molµŖĘų£Øg£©Óė3molĒāĘų£Øg£©Éś³É2mol°±Ęų£Øg£©·“Ó¦µÄČČĮæĪŖ92.4kJ£¬ÓÉÓŚøĆ·“Ó¦ŹĒæÉÄę·“Ó¦£¬¼ÓČė1molN2ŗĶ3molH2²»æÉÄÜĶźČ«·“Ó¦£¬ĖłŅŌ·Å³öµÄČČĮæ×ÜŹĒŠ”ÓŚ92.4kJ£¬
¹Ź“š°øĪŖ£ŗŠ”ÓŚ£»N2ŗĶH2µÄ·“Ó¦ŹĒæÉÄę·“Ó¦£¬1 mol N2ŗĶ3 mol H2³ä·Ö·“Ӧɜ³ÉµÄNH3Ņ»¶ØŠ”ÓŚ2 mol£¬¹Ź·Å³öµÄČČĮæŠ”ÓŚĄķĀŪ¼ĘĖćÖµ£»
£Ø2£©Čō·“Ó¦5·ÖÖÓ“ļµ½Ę½ŗāŹ±ĘųĢå×ÜĪļÖŹµÄĮæĪŖ2.5mol£¬ŌņĘųĢå×ÜĪļÖŹµÄĮæ¼õÉŁĮĖ£ŗ1mol+3mol-2.5mol=1.5mol£¬
N2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷n
3 2
n 1.5mol
Ōņn=$\frac{1.5mol”Į3}{2}$=2.25mol£¬
Ōņ5minÄŚÓĆĒāĘų±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗv£ØH2£©=$\frac{\frac{”÷n}{V}}{”÷t}$=$\frac{\frac{2.25mol}{2L}}{5min}$=0.225mol/£ØL•min£©£»
“ļµ½Ę½ŗāŹ±ĒāĘųµÄ×Ŗ»ÆĀŹĪŖ£ŗ$\frac{2.25mol}{3mol}$”Į100%=75%£¬
¹Ź“š°øĪŖ£ŗ0.225mol/£ØL•min£©£»75%£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·æÉÄę·“Ó¦ĢŲµćĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕ²īĮæ·ØŌŚ»Æѧ¼ĘĖćÖŠµÄÓ¦ÓĆ£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪöÄÜĮ¦¼°Įé»īÓ¦ÓĆÄÜĮ¦£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 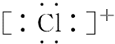 | B£® | 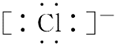 | C£® | 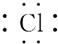 | D£® | 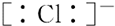 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
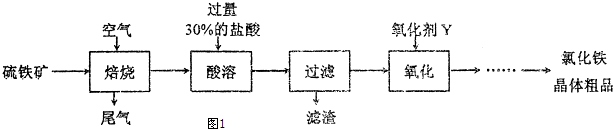
²éæ““š°øŗĶ½āĪö>>
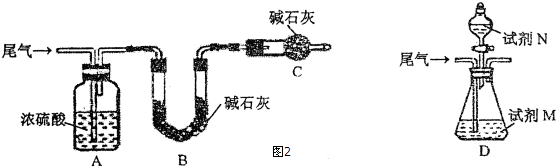
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀĮÓėĻ”ŃĪĖįµÄ·“Ó¦ | B£® | Ba£ØOH£©2•8H2OÓėNH4ClµÄ·“Ó¦ | ||
| C£® | ×ĘČȵÄĢ¼Óė¶žŃõ»ÆĢ¼µÄ·“Ó¦ | D£® | NaOHÓėHClµÄ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ó²¶ČÓɓ󵽊”£ŗ½šøÕŹÆ£¾Ģ¼»Æ¹č£¾¾§Ģå¹č | |
| B£® | ČŪµćÓÉøßµ½µĶ£ŗSiC£¾Si£¾SiO2£¾Ge | |
| C£® | ·ŠµćÓÉøßµ½µĶ£ŗNH3£¾PH3£¾AsH3£¾SbH3 | |
| D£® | ¾§øńÄÜÓɓ󵽊”£ŗNaI£¾NaBr£¾NaCl£¾NaF |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
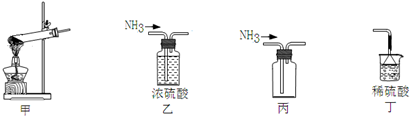
| A£® | ÓĆ¼××ö·¢Éś×°ÖĆ | B£® | ÓĆŅŅ³żČ„NH3ÖŠµÄŌÓÖŹ | ||
| C£® | ÓƱūĄ“ŹÕ¼ÆNH3 | D£® | Óƶ”½ųŠŠĪ²Ęų“¦Ąķ²¢·ĄÖ¹µ¹Īü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | V£ØB2£©=0.2mol/£ØL•S£© | B£® | V£ØA2£©=6mol/£ØL•min£© | ||
| C£® | V£ØAB£©=8mol/£ØL•min£© | D£® | V£ØB2£©=1.2mol/£ØL•min£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com