

分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,加入稀硫酸反应后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液1为硫酸铜、硫酸亚铁溶液,“除杂”时先通入足量过氧化氢将Fe2+氧化成Fe3+,得到溶液2为硫酸铜、硫酸铁溶液,再加入CuO固体调节溶液pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液3为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,步骤Ⅰ中涉及的反应是Cu2(OH)2CO3和FeCO3与硫酸发生复分解反应生成二氧化碳,
(2)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于除去,所加试剂能和亚铁离子反应且不能引入新的杂质;
(3)步骤Ⅲ加入CuO目的是调节溶液的PH使铁离子全部沉淀;
(4)溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤;
(5)孔雀石与焦炭一起加热可以生成Cu、二氧化碳和水,依据原子守恒配平书写化学方程式;
(6)称量粉末的质量为1.6g为硫酸铜质量,受热前后质量变化为结晶水的质量,结合化学方程式CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O计算x.
解答 解:孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,加入稀硫酸反应后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液1为硫酸铜、硫酸亚铁溶液,“除杂”时先通入足量过氧化氢将Fe2+氧化成Fe3+,得到溶液2为硫酸铜、硫酸铁溶液,再加入CuO固体调节溶液pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液3为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,步骤Ⅰ中涉及的反应是Cu2(OH)2CO3和FeCO3与硫酸发生复分解反应生成二氧化碳,反应的化学方程式为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
(2)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于沉淀除去,所加试剂能和亚铁离子反应且不能引入新的杂质,
a.KMnO4溶液加入后,能氧化亚铁离子,但会引入钾离子、锰离子,故a不符合;
b.加入H2O2会氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故b符合;
c.Fe粉不能氧化亚铁离子,故c不符合;
d.加入KSCN溶液结合铁离子形成络合物,不能氧化亚铁离子,亚铁离子的存在会干扰硫酸铜晶体的析出,故d不符合;
故答案为:b;
(3)步骤Ⅲ加入CuO目的是和酸反应,调节溶液的PH使铁离子全部沉淀,故答案为:消耗酸使溶液pH升高,便于Fe3+形成沉淀除去;
(4)操作Ⅳ是溶液中得到溶质的方法是蒸发浓缩、冷却结晶、过滤洗涤;
故答案为:加热浓缩;冷却结晶;
(5)孔雀石与焦炭一起加热可以生成Cu、二氧化碳和水,依据原子守恒配平书写得到的化学方程式为:Cu2(OH)2CO3+C$\frac{\underline{\;\;△\;\;}}{\;}$ 2Cu+2CO2↑+H2O;
故答案为:Cu2(OH)2CO3+C$\frac{\underline{\;\;△\;\;}}{\;}$ 2Cu+2CO2↑+H2O;
(6)称取2.4g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g为硫酸铜质量,n(CuSO4)物质的量=$\frac{1.6g}{160g/mol}$=0.01mol,受热质量减少2.4g-1.6g=0.8g,水的物质的量=$\frac{0.8g}{18g/mol}$=0.044mol;
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O
1 x
0.01mol 0.044mol
x=4.4
故答案为:4.4.
点评 本题考查了物质分离方法和提纯的应用,主要是物质性质的理解应用,掌握实验基本操作和流程分析是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X3Y2 | B. | X2Y | C. | Y3X2 | D. | Y2X3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
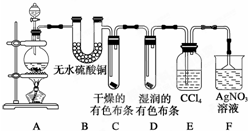 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 氨水 | C. | KMnO4,ZnCO3 | D. | H2O2,ZnO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com