
| A、建立燃烧现象的氧化学说 |
| B、提出化学元素的概念 |
| C、提出原子学说 |
| D、放射性元素的发现 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 淀粉溶液和稀H2SO4混合加热后,再加新制的Cu(OH)2悬浊液煮沸 | 无砖红色沉淀产生 | 淀粉未水解 |
| C | 向苯酚浓溶液中滴入溴水,振荡 | 无白色沉淀产生 | 苯酚与溴水不反应 |
| D | 将乙醇和浓硫酸共热至170℃后,将生成的气体通入酸性KMnO4溶液中 | KMnO4溶液褪色 | 不能证明乙烯能使KMnO4溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:
某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、45 | B、22.5 |
| C、11.25 | D、6.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mlHCL |
| NaOH |
| 100mlNaOH |
| HCL |
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
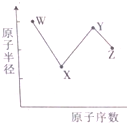 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥ | B、①⑤⑥ |
| C、②③④ | D、①⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com