
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
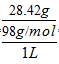 =0.29mol/L
=0.29mol/L

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.②④ | C.③④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
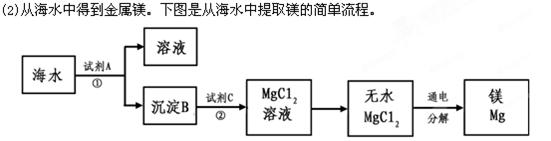 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石油裂解得到的汽油是纯净物 |
| B.石油分馏和煤干馏都是化学变化 |
| C.干馏煤可以得到甲烷、苯和氨等重要化工原料\ |
| D.水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。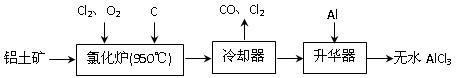
 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 研究的一项重要任务。
研究的一项重要任务。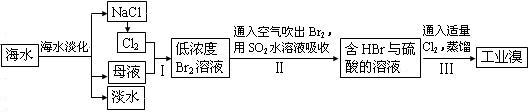
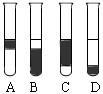 ②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
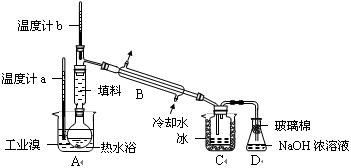
 请你参与分析讨论:
请你参与分析讨论: 为除去该产物中仍残留的少量Cl2,可向其中加入 ▲ 溶液,充分反应后,再进行的分离操作是 ▲ 。
为除去该产物中仍残留的少量Cl2,可向其中加入 ▲ 溶液,充分反应后,再进行的分离操作是 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
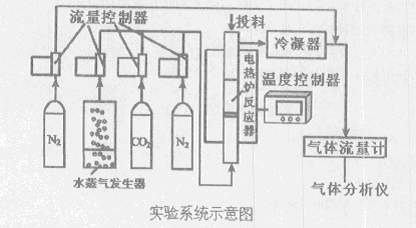
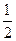 O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol H2(g)+CO2(g)
H2(g)+CO2(g)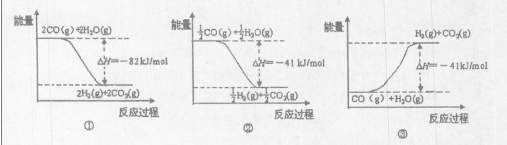
 H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为 .
H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为 .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com