
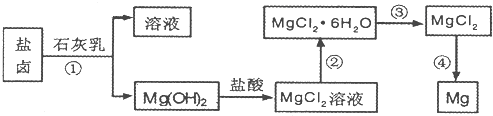
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
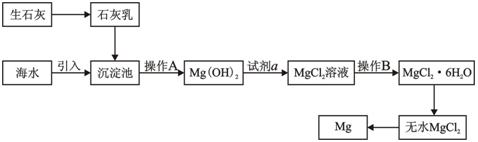
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ____,写出在沉淀池的离子方程式 ____。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 ____。
(3)操作A是 ____, 操作B是 ____。
(4)加入的足量试剂a是 ____(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 ____。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁? ____。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 ____(填“同意”或“不同意”)该同学的想法,理由是 ____。
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
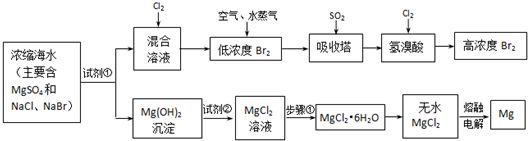
| ||
| ||
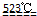 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑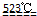 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑查看答案和解析>>
科目:高中化学 来源: 题型:

| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是:(四) | ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 是否正确 | 简述理由 | |
| 学生1的观点 | 否 否 |
海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 学生2的观点 | 否 否 |
能源消耗大,海水的综合利用低,成本高 能源消耗大,海水的综合利用低,成本高 |
| 学生3的观点 | 是 是 |
镁离子富集浓度高,成本低 镁离子富集浓度高,成本低 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com