
| �¶�/�� | 240 | 250 | 260 | 270 |
| ƽ����ѹǿ/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| ƽ����Ũ��/mol•L-1 | 2.4��10-3 | 3.4��10-3 | 4.8��10-3 | 6.8��10-3 |
���� �÷�ĩ��Fe���O����һδ֪Ԫ�ع�����Ԫ�أ���ȡ2.22g������W�ķ�ĩ��������ϡ���ᣬ��Ӧ�����Һ�м��뺬��3.20gNaOH����Һ��n��NaOH��=$\frac{3.20g}{40g/mol}$=0.08mol��ǡ����ȫ��Ӧ�����ˣ���ϴ�Ӻ�ij���������գ��õ�����ɫ��ĩ1.60gΪFe2O3�����ʵ���n��Fe2O3��=$\frac{1.60g}{160g/mol}$=0.01mol��n��Fe��=0.02mol����������Һ��һ���������������տɵõ�һ�ִ����IJ����ᾧˮ����7.10g���ж�ֻ����Na2SO4�����ʵ���n��Na2SO4��=$\frac{7.10g}{142g/mol}$=0.05mol��n��Na��=0.05mol��2-0.08=0.02mol���������Ԫ����Դ�ں���������W��˵����һ��Ԫ��ΪNa��n��Na����n��Fe����n��O��=0.02��0.02��$\frac{2.22g-0.02mol��23g/mol-0.02mol��56g/mol}{16g/mol}$=1��1��2����W��ѧʽΪNaFeO2��
��1��������֪��һ��Ԫ��ΪNa��
��2���ٸû�����W�Ļ�ѧʽΪNaFeO2��
�ڻ�����W������ϡ���ᷴӦ�����������������ƺ�ˮ��
��3���ȸ��ݷ�ӦCoC2O4��S��?CoO��S��+CO��g��+CO2��g������֪ƽ��ʱ�����������Ũ��֮��Ϊ1��1������Ũ�����CO��g��+CO2��g����ƽ��Ũ�ȣ�������ƽ�ⳣ���ı���ʽ�����㣬�����¶ȱ仯��������ѹǿ��Ӱ���жϷ�Ӧ�������
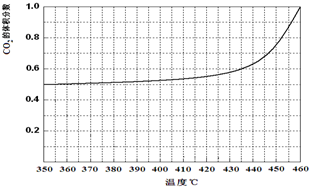
��4���¶ȼ�����350�棬CO2�����������ʼ�����仯�����¶�����ƽ��������У�������̼��һ����̼�������䣬������̼�������������һ����̼���������С��
��� �⣺��1���÷�ĩ��Fe���O����һδ֪Ԫ�ع�����Ԫ�أ���ȡ2.22g������W�ķ�ĩ��������ϡ���ᣬ��Ӧ�����Һ�м��뺬��3.20gNaOH����Һ��n��NaOH��=$\frac{3.20g}{40g/mol}$=0.08mol��ǡ����ȫ��Ӧ�����ˣ���ϴ�Ӻ�ij���������գ��õ�����ɫ��ĩ1.60gΪFe2O3�����ʵ���n��Fe2O3��=$\frac{1.60g}{160g/mol}$=0.01mol��n��Fe��=0.02mol����������Һ��һ���������������տɵõ�һ�ִ����IJ����ᾧˮ����7.10g���ж�ֻ����Na2SO4�����ʵ���n��Na2SO4��=$\frac{7.10g}{142g/mol}$=0.05mol��n��Na��=0.05mol��2-0.08=0.02mol���������Ԫ����Դ�ں���������W��˵����һ��Ԫ��ΪNa��
�ʴ�Ϊ��Na��
��2������ȡ2.22g������W�ķ�ĩ��������ϡ���ᣬ��Ӧ�����Һ�м��뺬��3.20gNaOH����Һ��n��NaOH��=$\frac{3.20g}{40g/mol}$=0.08mol��ǡ����ȫ��Ӧ�����ˣ���ϴ�Ӻ�ij���������գ��õ�����ɫ��ĩ1.60gΪFe2O3�����ʵ���n��Fe2O3��=$\frac{1.60g}{160g/mol}$=0.01mol��n��Fe��=0.02mol����������Һ��һ���������������տɵõ�һ�ִ����IJ����ᾧˮ����7.10g���ж�ֻ����Na2SO4�����ʵ���n��Na2SO4��=$\frac{7.10g}{142g/mol}$=0.05mol��n��Na��=0.05mol��2-0.08=0.02mol���������Ԫ����Դ�ں���������W��˵����һ��Ԫ��ΪNa��n��Na����n��Fe����n��O��=0.02��0.02��$\frac{2.22g-0.02mol��23g/mol-0.02mol��56g/mol}{16g/mol}$=1��1��2����W��ѧʽΪNaFeO2��
�ʴ�Ϊ��NaFeO2��
�ڻ�����W������ϡ���ᷴӦ�����������������ƺ�ˮ�������ᷴӦ�Ļ�ѧ����ʽΪ��2NaFeO2+4H2SO4=Na2SO4+Fe2��SO4��3+4H2O��
�ʴ�Ϊ��2NaFeO2+4H2SO4=Na2SO4+Fe2��SO4��3+4H2O��
��3���ȸ��ݷ�ӦCoC2O4��S��?CoO��S��+CO��g��+CO2��g������֪ƽ��ʱ�����������Ũ��֮��Ϊ1��1������Ũ��Ϊ3.4��10-3 �����CO��g����CO2��g����ƽ��Ũ��Ϊ1.7��10-3mol/L��������ƽ�ⳣ���ı���ʽ������K=c��CO��c��CO2��=1.7��10-3mol/L��1.7��10-3mol/L=2.89��10-6�������¶ȱ仯��������ѹǿ��Ӱ���жϷ�Ӧ����������¶���������ѹǿ����ϻ�ѧ��Ӧ��֪����ƽ��������У�����ӦΪ���ȷ�Ӧ����Ӧ�ʱ��H��0��
�ʴ�Ϊ��2.89��10-6������
��4���¶ȼ�����350�棬CO2�����������ʼ�����仯�����¶�����ƽ��������У�������̼��һ����̼�������䣬������̼�������������һ����̼���������С��ͼ��仯Ϊ����ͼ 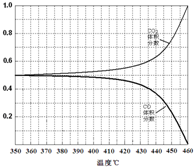 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼��ѧ���Ķ���Ŀ��ȡ��Ϣ���������������������ʵ�������ȣ���Ŀ���ѣ���Ҫѧ��������ʵ�Ļ���֪ʶ���������֪ʶ��������������


 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaO | B�� | Cl2 | C�� | H2SO4 | D�� | SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
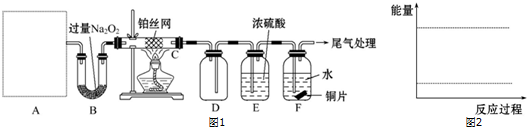
 �мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫����6mol/L��������Һ�У���ͬѧ���缫����6mol/L��NaOH��Һ�У�ʵ��װ����ͼ��ʾ��
�мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫����6mol/L��������Һ�У���ͬѧ���缫����6mol/L��NaOH��Һ�У�ʵ��װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
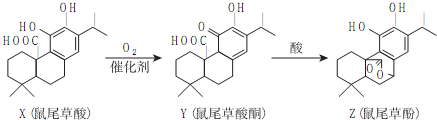
| A�� | X��Z���ڷ����廯���� | |
| B�� | X��Y��Z������FeCl3��Һ������ɫ��Ӧ | |
| C�� | 1molX��1molZ��NaOH��Һ��Ӧ�����������3molNaOH | |
| D�� | Z����������Ȼ�̼��Һ�����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 18�˵�D216O�к��е�������Ϊ9NA | |
| B�� | ��״���£�22.4LSO3���е�ԭ����Ϊ4NA | |
| C�� | 80ml10mol/L����������MnO2���ȷ�Ӧ��������Cl2������Ϊ0.2NA | |
| D�� | ����ͭ�����У�������������6.4gʱ����·��ת�Ƶ���Ϊ0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�0.2NA��NH3���ӵ�����Ϊ3.4g | |
| B�� | 2.7g����������������ĿΪ0.3NA | |
| C�� | 7.1 g Cl2��Ϊ������ʱ���õ��ĵ�����һ��Ϊ0.1NA | |
| D�� | 1L 0.2mol/L��������Һ�к��е�SO42-������ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com