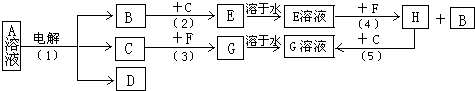
解:(1)B在C中燃烧时,火焰呈苍白色,说明B是H
2,C是Cl
2,则E是HCl气体,E溶液为盐酸.A和D的焰色反应为黄色,说明A和D中含Na
+.G和D溶液混和,产生红褐色沉淀,为Fe(OH)
3沉淀,说明G中含Fe
3+,结合F为常见金属单质,推得F为金属Fe.反应(3)为Cl
2和Fe反应生成FeCl
3,反应(4)为盐酸和Fe反应生成FeCl
2和H
2,反应(5)为FeCl
2和Cl
2反应生成FeCl
3.B是H
2,C是Cl
2,D中含Na
+,根据电解原理推得反应(1)是电解饱和食盐水,即A溶液为NaCl溶液.反应(1)方程式为:2NaCl+2H
2O═2NaOH+H
2↑+Cl
2↑,生成1molH
2转移2mol电子,则生成0.1molH
2,转移的电子的物质的量为0.2mol,C与F反应的化学方程式为:2Fe+3Cl
2
2FeCl
3,
故答案为:0.2mol;2Fe+3Cl
2
2FeCl
3;
(2)反应(1)方程式为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
反应(2)方程式为:H
2+Cl
2
2HCl,
反应(3)方程式为:2Fe+3Cl
2
2FeCl
3,
反应(4)方程式为:2HCl+Fe═FeCl
2+H
2↑,
反应(5)方程式为:2FeCl
2+Cl
2═2FeCl
3.
上述5个反应中都有化合价的变化,所以都属于氧化还原反应.
故答案为:(1)、(2)、(3)、(4)、(5).
分析:根据电解原理、氧化还原反应、元素化合物知识进行分析,同时结合特征反应与特征现象推断解答;B在C中燃烧时,火焰呈苍白色,说明B是H
2,C是Cl
2,则E是HCl气体,E溶液为盐酸.A和D的焰色反应为黄色,说明A和D中含Na
+.G和D溶液混和,产生红褐色沉淀,为Fe(OH)
3沉淀,说明G中含Fe
3+,结合F为常见金属单质,推得F为金属Fe.反应(3)为Cl
2和Fe反应生成FeCl
3,反应(4)为盐酸和Fe反应生成FeCl
2和H
2,反应(5)为FeCl
2和Cl
2反应生成FeCl
3.B是H
2,C是Cl
2,D中含Na
+,根据电解原理推得反应(1)是电解饱和食盐水,即A溶液为NaCl溶液;依据判断出的物质分析解答.
点评:本题考查元素及其化合物知识,同时涉及到电解原理、氧化还原反应的判断和电子转移的分析,解题的突破口抓住特征现象,如火焰呈苍白色、焰色反应为黄色、红褐色沉淀等,结合其它已知信息整个过程就可迎刃而解.

 2FeCl3,
2FeCl3, 2FeCl3;
2FeCl3; 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2HCl,
2HCl, 2FeCl3,
2FeCl3,












