

分析 (1)还原剂的化合价要升高,氧化剂化合价降低生成还原产物;
(2)根据反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,生成MnCl2为还原产物,
16HCl中有10HCl的Cl化合价由-1升高到0价,转移电子数为10mol来标电子转移情况;
(3)根据还原剂HCl的Cl化合价由-1升高到0价进行计算.
解答 解:(1)反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,生成MnCl2为还原产物,
16HCl中有10HCl的Cl化合价由-1升高到0价,所以还原剂为HCl,故答案为:HCl;MnCl2;
(2)反应2KMnO4+16HCl=2MnCl2↑+2KCl+5C12↑+8H2O,KMnO4中Mn化合价由+7降低到+2,则KMnO4为氧化剂,生成MnCl2为还原产物,
16HCl中有10HCl的Cl化合价由-1升高到0价,转移电子数为10mol,所以双线桥表示为: ,故答案为:
,故答案为: ;
;
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,还原剂HCl的Cl化合价由-1升高到0价,所以有0.8mol还原剂被氧化,则转移电子的物质的量是0.8 mol,故答案为:0.8 mol.
点评 本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入金属钠,平衡正向移动,c(H+)增大 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
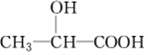 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
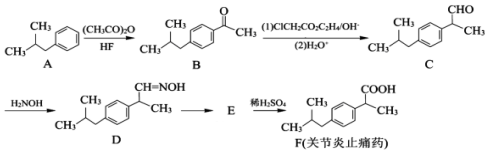
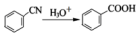 ;②
;②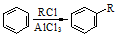 ; ③
; ③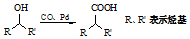 .
.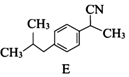 .
.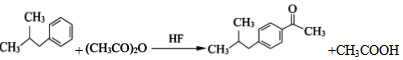 .
.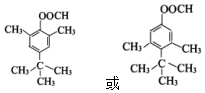 (写一种).
(写一种).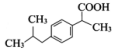 )的一种改良法是以2-甲基-1-丙醇(
)的一种改良法是以2-甲基-1-丙醇(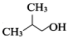 )、苯、
)、苯、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
ⅰ、取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中 | 气泡产生,澄清的石灰水变浑浊 | 证明含有碳酸根离子 |
| ⅱ、取第二份溶液,分别滴加稀盐酸和氯化钡 | 白色沉淀 | 证明含有硫酸根离子 |
| ⅲ、取第三份溶液加入过量BaCl2溶液,过滤,除去SO42-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 证明含有氯离子. |
| ⅳ、取第四份溶液进行焰色反应 | 透过蓝色钴玻璃火焰呈紫色 | 证明含有K+ |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:实验题
某学生欲配制6.0mol/L的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L (保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,注入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+ 、HCO3-、CO32-、Cl-、NO3-、SO42- 中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。则下列说法正确的是
A.原溶液中一定含有HCO3-或CO32-
B.原溶液中可能含有Ba2+、Al3+
C.若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:实验题
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
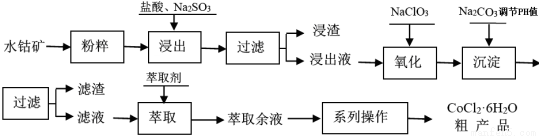
已知:① 浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
② CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3,其主要作用是(用化学方程式说明) 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式 ;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“系列操作”中包含3个基本实验操作依次是 、 和过滤。
(4)浸出液加Na2CO3调pH至5.2 时,所得滤液中金属离子有 ;萃取液中含有的主要金属阳离子是 。
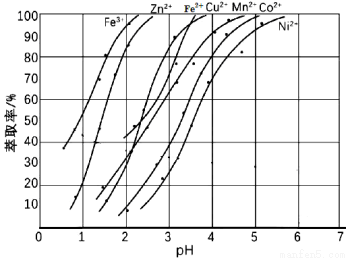
(5)为寻找合适的萃取剂,发现某种萃取剂对部分离子的萃取率与溶液pH 的关系如下图所示。请写出有关萃取规律,并说明本流程是否能用该萃取剂进行萃取。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
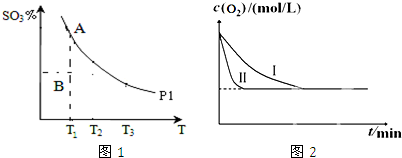
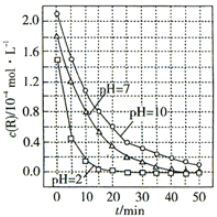
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com