
【题目】将m g由铜与镁组成的混合物加入含n mol HNO3的稀硝酸中,两者恰好完全反应,生成V1 mL标准状况下的NO气体(假定还原产物只有NO),再向所得溶液中加入V2 mL 6 mol·L-1 NaOH溶液,溶液中金属离子恰好完全沉淀,测得生成(m+10.2)g沉淀。下列相关判定一定不正确的是( )
A. m=19.2B. n=0.8
C. V1=4.48D. V2=200
【答案】AD
【解析】
将mg由铜与镁组成的混合物加入含nmolHNO3的稀硝酸中,两者恰好完全反应,生成V1 mL标准状况下的NO气体(假定还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,再向所得溶液中加入V2mL6mol·L-1NaOH溶液,溶液中金属离子恰好完全沉淀,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,测得生成(m+10.2)g沉淀,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加10.2g,则氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,据此答题。
A.氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,则氢氧根的物质的量为![]() =0.6mol,则镁和铜的总的物质的量为0.3mol,假设全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故A错误;
=0.6mol,则镁和铜的总的物质的量为0.3mol,假设全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=8/3n(金属)=0.3mol×8/3=0.8mol,故B正确;
C.氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,氢氧根的物质的量为![]() =0.6mol,则镁和铜的总的物质的量为0.3mol,根据电子转移守恒可知生成的NO物质的量为
=0.6mol,则镁和铜的总的物质的量为0.3mol,根据电子转移守恒可知生成的NO物质的量为![]() =0.2mol,则在标准状况下,生成NO的体积V1=0.2mol×22.4L/mol=4.48L,故C正确;
=0.2mol,则在标准状况下,生成NO的体积V1=0.2mol×22.4L/mol=4.48L,故C正确;
D.因为恰好完全反应,则参加反应氢氧化钠的物质的量为0.6mol,需要氢氧化钠溶液体积=![]() =0.1L=100mL,故D错误。
=0.1L=100mL,故D错误。
故选AD。


科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①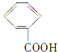 ②
②![]() ③CH4 ④
③CH4 ④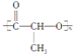 ⑤
⑤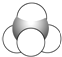
⑥ ⑦
⑦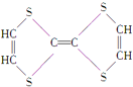
⑧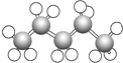 ⑨
⑨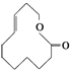 ⑩
⑩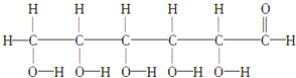
(1)上述表示方法中属于结构简式的为 _________;属于结构式的为 _______________;属于键线式的为 ________________;属于比例模型的为 _______________;属于球棍模型的为 __________________;
(2)写出⑨的分子式: ________________;
(3)②的分子式为 ________________,最简式为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中能大量共存的是( )
A.K+、Na+、OH-、Cl﹣
B.Na+、K+、Cl﹣、SO42-
C.Ca2+、Na+、CO32-、NO3-
D.Cu2+、SO42-、Mg2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________________。
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体F的电子式为____________,化合物I中含有的化学键类型有________________。
(4)转化①的离子方程式为_______________________________________________________。
转化⑦的离子方程式为_______________________________________________________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种用于合成γ分泌调节剂的药物中间体,其结构简式如右图所示。下列有关化合物X的说法正确的是( )
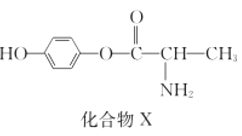
A. 化合物X分子中没有手性碳原子
B. 化合物X能与FeCl3溶液发生显色反应
C. 1 mol化合物X最多能与2 mol NaOH反应
D. 化合物X能发生水解反应,一定条件下可水解得到一种α氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了定量测定浓硫酸具有强氧化性的最低浓度,某研究小组设计的实验方案为:取18.4mol·L-1浓硫酸a mL与足量锌于A中反应,将生成的气体通入某溶液并测定生成沉淀的质量.
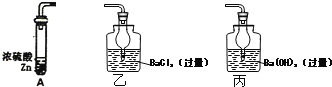
(1)A中产生的气体应通入图中__________(填“乙”或“丙”)装置.
(2)有同学认为要减小实验误差,需要增加一个将反应生成的SO2全部排出的操作.但也有同学认为没有必要,其理由是____________________________________.
(3)若沉淀质量为b g,则浓硫酸具有强氧化性时的最低浓度为________________.(用 含a、b的代数式表示,忽略反应过程中浓硫酸体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据在元素周期表中位置靠近的元素具有相似的性质这一规律,可利用元素周期表寻找新材料。下列说法不正确的是
A. 在金属元素和非金属元素的交界处寻找半导体材料
B. 在过渡元素中寻找耐高温材料
C. 在过渡元素中寻找优良的催化剂
D. 在金属元素区域寻找新型农药材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com