


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
 磷酸的结构式如图所示,磷酸分子与磷酸分子的羟基之间可以脱去水.三个磷酸分子可以脱去两个水分子生成三聚磷酸.含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是( )
磷酸的结构式如图所示,磷酸分子与磷酸分子的羟基之间可以脱去水.三个磷酸分子可以脱去两个水分子生成三聚磷酸.含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是( )| A、Na5P3O1212mol |
| B、Na3H2P3O10 9mol |
| C、Na5P3O109mol |
| D、Na2H3P3O10 12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

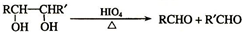
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
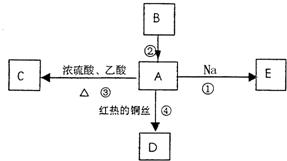
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液Y中加入过量的NaOH溶液后过滤,滤液和沉淀中各含两种金属元素 |
| B、该矿石成分中能溶于盐酸的都是碱性氧化物,不溶的是酸性氧化物 |
| C、溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
| D、沉淀X的成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

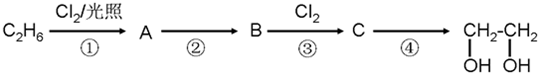
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com