
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是( )
A. SO2既是氧化产物又是还原产物
B. CuFeS2仅作还原剂,硫元素被氧化
C. 每生成1 molCu2S,有4mol硫被氧化
D. 每转移1.2 mol电子,有0.2 mol硫被氧化
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: 2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由﹣2价升高到+4价,氧气中O元素由0降低为﹣2价,以此来解答.
解答: 解:A.2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由﹣2价升高到+4价,氧气中O元素由0降低为﹣2价,则SO2既是氧化产物又是还原产物,故A正确;
B.2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由﹣2价升高到+4价,硫元素失电子被氧化,但该反应中CuFeS2既是氧化剂又是还原剂,故B错误;
C.被氧化的S元素由﹣2价升高到+4价,每生成1 molCu2S,则生成1mol二氧化硫,有1mol硫被氧化,故C错误;
D.2CuFeS2+O2=Cu2S+2FeS+SO2中,S元素由﹣2价升高到+4价,该反应中转移电子数是6,所以每转移1.2 mol电子,则有0.2 mol硫被氧化,故D正确;
故选AD.
点评: 本题考查氧化还原反应,明确元素的化合价是解答本题的关键,CuFeS2中各元素的化合价是解答的难点和易错点,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++CO32﹣═CO2↑+H2O的化学反应的组合共有()
A. 6个 B. 9个 C. 12个 D. 15个
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A. “血液透析”利用了胶体的性质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 明矾能水解生成Al(OH)3胶体,可用作净水剂
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5gHCl溶解在1L水中(水的密度近似为1g•mL﹣1)所得溶液的密度为ρg•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1mol•L﹣1
B. 所得溶液中含有NA个HCl分子
C. 36.5gHCl气体占有的体积为22.4L
D. 所得溶液的质量分数:w=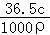
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A. 9.0 L B. 13.5 L C. 15.7 L D. 16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.6g Na投入到95.6g水中,所得溶液中溶质的质量分数为( )
A. 小于4.6% B. 等于8.0% C. 小于8.0% D. 大于8.0%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com