
【题目】下列叙述错误的是
A.NH3的喷泉实验说明氨气极易溶于水
B.NO 和NH3均可用排空气法收集
C.盛液溴的瓶内加少量水可防止液溴的挥发
D.NH3遇到挥发性的强酸能冒白烟
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+ 、Mg2+、Cu2+、NH4+、Al3+。当加入1 种淡黄色固体并加热时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。
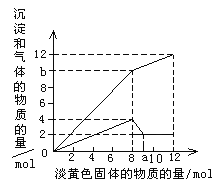
(1)淡黄色固体是__________________________。
(2)可知溶液中一定没有的离子是 ,理由是 。
(3)请解释为什么在投入8mol淡黄色固体后,产生气体的量在减少 。
(4)写出淡黄色固体加入的量为8mol到10mol之间发生的所有离子方程式 。
(5)所含离子的物质的量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS)。羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。反应方程式为:
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
①羰基硫的电子式为_________其含有的共价键类型是________共价键。
②下列能说明碳与硫两元素非金属性相对强弱的是_____________。
a.相同条件下水溶液的pH:Na2CO3 > Na2SO4
b.酸性:H2SO3 > H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式__________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
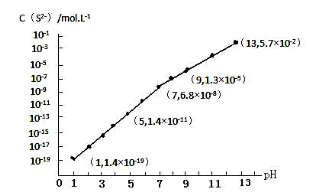
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
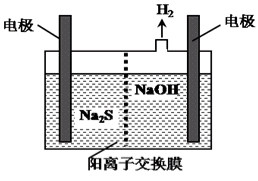
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:______________________。
②Na2S溶液中离子浓度由大到小顺序:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
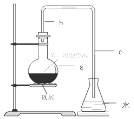
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________;此锡粉样品中锡的质量分数:____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
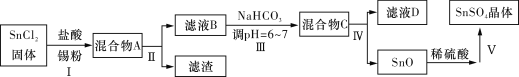
①步骤Ⅰ加入Sn粉的作用:____________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________。
③步骤Ⅲ生成SnO的离子方程式:__________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________,证明已洗净。
⑤步骤Ⅴ操作依次为___________________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
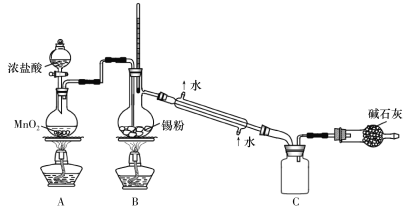
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如下表所示:
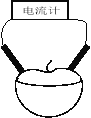
已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/A |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域c(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H10406(s)+ 80O2(g)=57CO2(g)+52H2O(l),己知燃烧1kg该化合物释放出热量3.8×l04kJ。油酸甘油酯的燃烧热△H为( )
A.3.8×104kJ/mol B.-3.8×104kJ/mol
C.3.4×104kJ/mol D.-3.4×104kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CO2 C.CH3CH2OH D.CH3COOCH2CH3
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
![]()
反应①的化学方程式为___________________ ①反应类型是__________________
②反应类型是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com