
 .
.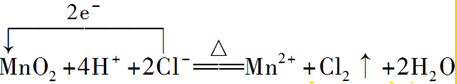 .
.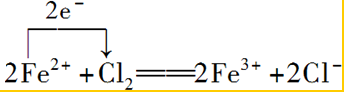 .
. 分析 ①Cu和AgNO3溶液反应生成硝酸铜和金属银的反应中,Cu元素的化合价升高,Ag元素的化合价降低,该反应中转移2e-,以此来解答;
②二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应中Mn元素的化合价降低,转移2e-,以此来解答;
③向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,以此来解答.
解答 解:①Cu和AgNO3溶液反应生成硝酸铜和金属银,离子反应为:Cu+2Ag+═Cu2++2Ag,化合价升高值=化合价降低值=转移电子数=2,电子转移表示为: ,故答案为:
,故答案为: ;
;
②实验室制Cl2的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中Mn元素的化合价降低,转移2e-,则用单线桥标明电子转移的方向和数目: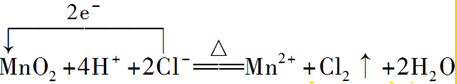 ;
;
故答案为: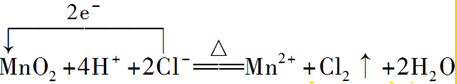 ;
;
③向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,则用单线桥标明电子转移的方向和数目: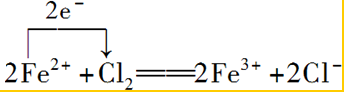 ;
;
故答案为: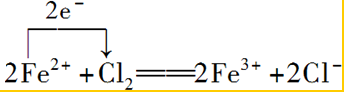 .
.
点评 本题考查学生离子方程式的书写以及氧化还原反应中的电子转移知识,属于基本知识的考查题,难度不大,注意从化合价的角度分析.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
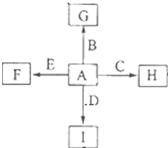 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com