
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
分析 对于可逆反应,反应物不可能全部转化为生成物,在反应中,加入催化剂、增大反应物浓度都可增大反应速率,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此解答.
解答 解:A.降温,化学反应速率减慢,故A错误;
B.加入催化剂,降低反应的活化能,增大活化分子的百分数,可增大反应速率,故B正确;
C.该反应为可逆反应,反应物不可能全部转化为生成物,故C错误;
D.达到平衡状态时,正逆反应速率相等,各物质的浓度不变但不一定相等,故D错误;
故选B.
点评 本题考查化学反应速率的影响以及化学平衡状态的判断等问题,为高考常见题型和高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握可逆反应的特点,难度不大.


科目:高中化学 来源: 题型:选择题
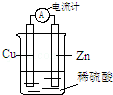
| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
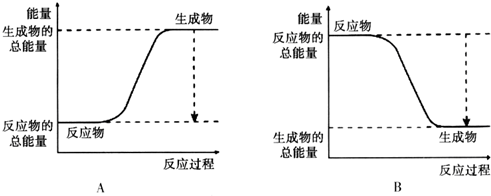
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
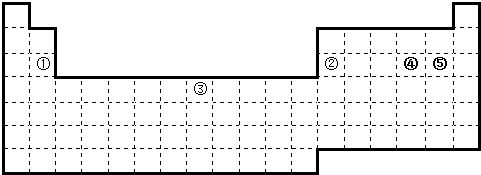
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com