
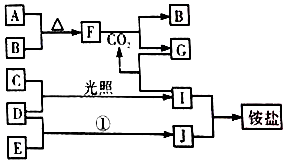
 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应 ,F
,F ;
; ;
;分析 化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐为NH4Cl,故C为Cl2,据此进行解答.
解答 解:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na,G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐为NH4Cl,C为Cl2,
(1)由上述分析可知,物质E为N2,其电子式为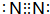 ;F为Na2O2,过氧化钠为离子化合物,其电子式为
;F为Na2O2,过氧化钠为离子化合物,其电子式为 ,
,
故答案为: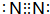 ;
; ;
;
(2)J为NH3,固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)F为Na2O2,B为O2,F和CO2的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,标况下11.2L氧气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,生成0.5mol氧气转移电子的物质的量为:0.5mol×2=1mol,
故答案为:1mol;
(4)C为Cl2、D为H2、E为N2、I为HCl、J为NH3,不同非金属元素之间形成极性共价键,同种非金属元素之间形成极性共价键,则以极性键结合的是I、J,以非极性键结合的是C、D、E,
故答案为:I、J;C、D、E;
(5)I为HCl,氯化氢为共价化合物,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(6)A为Na,其最高价氧化物对应水合物为NaOH,标况下1.12L二氧化碳的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,
60mL 1mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.06L=0.06mol,
NaOH与二氧化碳的物质的量之比=0.06mol:0.05mol=6:5,则反应后溶质为碳酸钠和碳酸氢钠的化合物,设Na2CO3、NaHCO3的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{x+y=0.05mol}\\{2x+y=0.06mol}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.01mol}\\{y=0.04mol}\end{array}\right.$,
所以n(Na2CO3):n(NaHCO3)=0.01mol:0.04mol=1:4,
故答案为:n(Na2CO3):n(NaHCO3)=1:4.
点评 本题考查无机物推断,涉及Na、Cl、N元素单质化合物性质,物质的状态、焰色反应及转化中特殊反应等是推断突破口,侧重基础知识的巩固,难度中等,注意掌握常见元素及其化合物性质,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
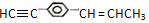 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 关系 | 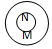 包含关系 | 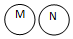 并列关系 | 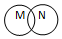 交集关系 |  重叠关系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
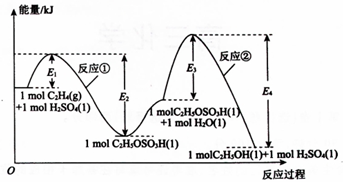 乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )
乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )| A. | H2SO4是乙烯间接水合法合成乙醇的催化剂 | |
| B. | 缩小容器容积,乙烯的转化率增大 | |
| C. | 反应①和反应②均为放热反应 | |
| D. | 反应②的反应热△H=-(E3-E4)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 阴离子的还原性C2-<D- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
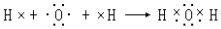 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
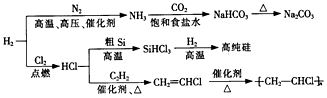
| A. | 使用催化剂可以降低合成氨反应的活化能 | |
| B. | 用澄清石灰水可以检验NaHCO3中是否混有Na2CO3 | |
| C. | 由粗硅制高纯硅的反应类型依次为化合反应、置换反应 | |
| D. | 聚合物 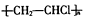 的链节为CH2=CHCl 的链节为CH2=CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com