
【题目】下列关于物质的组成、结构或性质的叙述中,正确的是
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
⑥次氯酸分子的电子式:![]()
⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6,两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
A.①③④⑦⑧B.⑤⑧⑨C.②③⑤⑥⑦⑨D.②⑦⑧⑨
【答案】B
【解析】
①HF的稳定性很强,是由于H-F键键能较大的原因,与氢键无关,故①错误;
②原子的价电子排布为(n-1)d6-8ns2的元素为Ⅷ族元素,而不是第ⅧB族,故②错误;
③能层为1时,只有一个1s轨道,有自旋相反的两个电子,故③错误;
④微观粒子的运动具有波粒二象性,用波粒二象性和概率波处理微观问题就是量子化,微观粒子的运动具有量子化特点,故④错误;
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素和价电子构型分别是:氢(1s1)、碳(2s22p2)、氧(2s22p4)、磷(3s23p3)、铁(3d64s2共5种元素,故⑤正确;
⑥次氯酸分子中含有O-H键,次氯酸分子的电子式为![]() ,故⑥错误;
,故⑥错误;
⑦同是3P能级,氩原子中的核电荷数较大,对电子的引力大,所以电子离核较近,故⑦错误;
⑧电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则S2-、Cl-、K+、Na+半径逐渐减小,故⑧正确;
⑨最外层有3个未成对电子的原子,最外层电子排布为ns2np3,p轨道上3个电子为未成对电子,位于第VA族,为主族元素,故⑨正确;
⑤⑧⑨正确,故答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近火焰点燃。
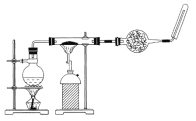
(1)观察到的现象是_________________________________,有关反应的化学方程式是________________________________。
(2)干燥管内可装入的试剂是____________________,其作用是______________________。
(3)实验开始时应先点燃________,实验结束时,应先熄灭________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的烃,它的摩尔质量为40g·mol-1,C能发生银镜反应,E能与小苏打反应产生气体,它们之间存在如下图所示的转化关系(反应所需条件已略去):
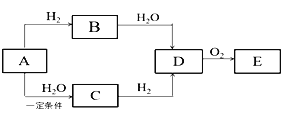
请回答:
(1) A的结构简式_______。
(2) C中含有官能团的名称是_______。
(3)在加热和催化剂条件下,D生成E的反应化学方程式为________。
(4)下列说法正确的是________。
a. B、C和E都能使酸性KMnO4溶液褪色
b. D和E都可以与金属钠发生反应
c. D和E在一定条件下反应可生成有香味的油状物质
d. 等物质的量B和D完全燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。
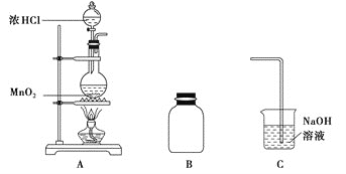
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。

①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:

(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,装置如图所示。下列说法错误的是( )

A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.每放出11.2L(标准状况)H2时,能回收98gH3PO4
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.a处进入稀氨水,d处流出浓H3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
氧化亚铜(Cu2O)可用于陶瓷、固体整流器。可用反应制备:2(CuSO4·5H2O) ![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为_______________。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因__________________。
(2)已知H2SO4的结构式如图所示: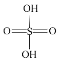 。上述反应中:
。上述反应中:
①在上述产物中,VSEPR模型与硫酸相同的是_________(填化学式,下同),与NO3-互为等电子体的一种分子是________。
②SO32-的杂化类型是________,请比较键角的大小:SO32-_____SO42-(填“>”“<”或“=”)
(3)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)四方晶系CuFeS2晶胞结构如图所示。已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______。
(2)写出A分别与B、C、D所形成化合物的化学式:_________、_________、_________。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于那类物质?__________写出它们相互反应的化学方程式。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com