
【题目】下列关于各图像的解释或结论正确的是( )
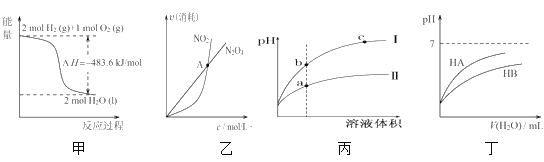
A.由甲可知:热化学方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强
D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
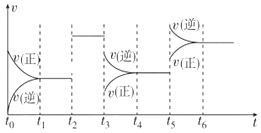
A.t2时加入了催化剂
B.t3时减小了压强
C.t5时升高了温度
D.t4~t5时间内X转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )
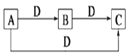
A. 若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B. 若A为固态非金属单质,D为O2,则A可以为单质硫
C. 若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D. 若A为18电子气态氢化物,D为O2,则A只能是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下物质间转化均能实现的是
A.MnO2![]() Cl2
Cl2 漂白粉
漂白粉
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.S(s) 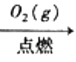 SO3(g)
SO3(g) ![]() H2SO4
H2SO4
D.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1的氨水滴定10.00 mL0.1molL-1的酸HA溶液,所加氨水的体积(V)与溶液中lg 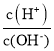 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
A.溶液中水的电离程度X<Y<Z
B.X点:c(A-)>c(H+)>c(NH4+)>c(OH-)
C.Y点:V(氨水)<10.00mL
D.Z点:2c(H+)+c(NH4+)=2c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是现代能源工业中重点考虑的综合利用技术。最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-90.8 kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-412 kJmol-1
③CO(g)+2H2(g)CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度
B.增大压强
C.降低温度
D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2 mol H-H键,同时生成3mol C-H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1mol CO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:

(1)压强P1______P2(填“>”、“<“或”=”)。
(2)M、N两点的化学反应速率:vM______vN(填“>”、“<“或“=”)
(3)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5 MPa)。
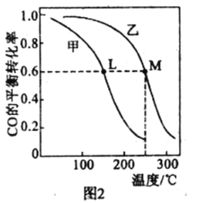
(4)甲、乙两个恒容密闭容器的体积相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)______2P(L),平衡常数:K(M)______K(L)(填“>”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com