
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
B. 39g Z2Y2中含有的离子数约为1.204×1024
C. 元素Z、R的最高价氧化物的水化物之间相互反应生成的盐一定是正盐
D. 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
【答案】D
【解析】
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,Y原子只能有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,根据Z、W、R处于同一周期,故Z、W为第三周期元素,原子序数W大于Z,故Z为Na,W为Al元素,结合物质的性质与元素周期律分析解答。
根据上述分析,X为H元素,Y为O元素,Z是Na元素,W是Al元素,R为S元素。
A.Y是O元素,Z是Na元素,W是Al元素,Y、Z、W具有相同电子层结构的离子分别为O2-、Na+、Al3+,核外电子排布相同的微粒,半径随着核电荷数的增加而减小,所以离子半径O2->Na+>Al3+,故A错误;
B.Na2O2由钠离子与过氧根离子构成,39gNa2O2中含有的离子数约为![]() ×3×6.02×1023mol-1 =9.03×1023,故B错误;
×3×6.02×1023mol-1 =9.03×1023,故B错误;
C.Z的最高价氧化物的水化物为NaOH,R的最高价氧化物的水化物为H2SO4,氢氧化钠与硫酸反应生成硫酸钠或硫酸氢钠,硫酸氢钠属于酸式盐,故C错误;
D.元素Y、R分别与元素X形成的化合物是氢化物,因为非金属性:Y(O元素)>R(S元素),所以对应的氢化物的稳定性:XmY>XmR,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
A. (l0b - 5a))mol/LB. (2b-a)mol/L
C. (![]() )mol/LD. (5b-
)mol/LD. (5b-![]() )mol/L
)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的性质比较正确的是( )
A. 稳定性:NH3<PH3 < SiH4 B. 酸性:HClO4 >H2SO4 > H3PO4
C. 碱性:KOH < NaOH < Mg(OH)2 D. 还原性:F— > Cl— > Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①写出实验室制取A的化学方程式:______________________________________;
②写出由A生成B的化学方程式:______________________________________;
③某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:_____________________________________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式:_______________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是

A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA
B. 标准状况下,22.4 L NO2气体中所含分子数目为NA
C. 100 g 17%的氨水,溶液中含有的NH3分子数小于NA
D. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)由1H216O与2H217O所代表的物质中,共有__________种元素,_________种原子,16O、17O的关系为________。
(2)红热木炭放入浓硫酸产生气体过程的化学反应方程式______________________。
(3)硫酸型酸雨产生的原因________________________________(化学方程式)
(4)SO2通入酸性高锰酸钾溶液中的离子方程式____________________________
(5)现有2.96 g铁的硫化物在空气中完全反应,生成2.40 g红色粉末(Fe2O3),并放出有刺激性气味的气体。将该气体通入溴水中,溶液褪色。用离子方程式表示溴水褪色的原因:___________________;通过计算,该铁的硫化物化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
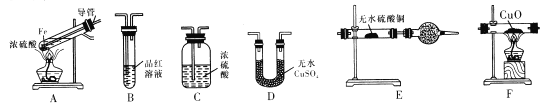
已知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为_____,装置E中的干燥管中盛放的物质为碱石灰,其作用是_______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
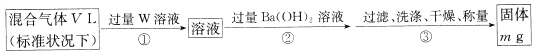
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_____________(用含V、m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com