
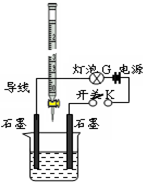
 某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.
某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.分析 (1)酸式滴定管用于盛放酸,则烧杯应为碱溶液;
(2)pH=a的酸溶液A的c(H+)=10-amol/L,pH=b的碱溶液Bc(OH-)=10b-11mol/L,若A为一元强酸,B为一元强碱,且a+b=11,则有b-11=-a,说明酸碱浓度相同,当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,说明二者等体积混合,以此解答该题.
解答 解:(1)酸式滴定管用于盛放酸,则烧杯应为碱溶液,故答案为:B;
(2)pH=a的酸溶液A的c(H+)=10-amol/L,pH=b的碱溶液Bc(OH-)=10b-11mol/L,若A为一元强酸,B为一元强碱,且a+b=11,则有b-11=-a,说明酸碱浓度相同,当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,说明二者等体积混合,反应后溶液呈中性,c(H+)=$\sqrt{1{0}^{-11}}$mol/L=10-5.5mol/L,则pH=5.5,故答案为:5.5.
点评 本题考查了影响溶液导电性因素、强弱电解质的判断,题目难度较大,注意掌握影响溶液导电性因素,把握离子积常数与pH的计算方法,把握相关计算公式的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:选择题
醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1 mol/L醋酸钡溶液中粒子浓度的比较,其中不正确的是
A. 2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:填空题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
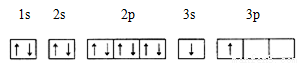
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)氢能的存储是氢能应用 的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
①Ti(BH4)2是一种过渡元素硼氢化物储 氢材料。
氢材料。
a、Ti2+基态的外围电子排布式可表示为________________。
b、BH4- 的空间构型是_____________(用文字描述)。
的空间构型是_____________(用文字描述)。
②液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是____________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是____________(多项选择)。
A.NH3分子中N原子采用sp3杂化
B.相同压强时,NH3沸点比PH3低
C.[Cu(NH3)4]2+离子中,N原子是配位原子
D.CN-的电子式为[:C┇┇N:]-
③2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。C60晶体易溶于 苯、CS2,C60是________分子(填“极性”或“非极性”)。
苯、CS2,C60是________分子(填“极性”或“非极性”)。
(3)已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别
如图I、II所示:
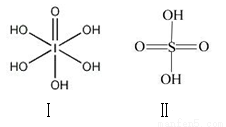
请从 结构角度比较二者酸性强弱:
结构角度比较二者酸性强弱:
H2SO4__________H5IO6(填“>”、 “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 | |
| C. | 若在含I-的滤液中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 水库中的水闸(钢板)与外加直流电源正极相连,可防止水闸被腐蚀 | |
| C. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| D. | 钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖与稀H2SO4共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| B. | 淀粉中加入20%H2SO4溶液在沸水浴中加热,使其水解 | |
| C. | 甘氨酸和蛋白质溶液中分别滴加0.1%茚三酮溶液并加热,溶液分别显蓝色和紫色 | |
| D. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入大量NO,ν正、ν逆均增大 | |
| B. | 恒温恒容下充入Ne,ν正、ν逆均不变 | |
| C. | ν正(NO)=2ν逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com