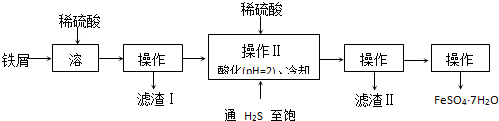
(1)下列根据实验事实得出的结论,正确的有
(填序号)
①试液
颜色无变化
溶液变为血红色
结论:试液中含有Fe
2+②试液
白色沉淀
沉淀不溶解
结论:试液中含有SO
42-③Ba(OH)
2溶液
溶液的导电能力先减弱后增强
结论:Ba(OH)
2和H
2SO
4之间的反应是离子反应
④稀硫酸
产生少量气泡
产生大量气泡,
结论:CuSO
4是锌与稀硫酸反应的催化剂
(2)现有三位同学分别利用浓盐酸、MnO
2共热制Cl
2,并用Cl
2和Ca(OH)
2反应制取少量漂白粉,设计了三套实验装置:
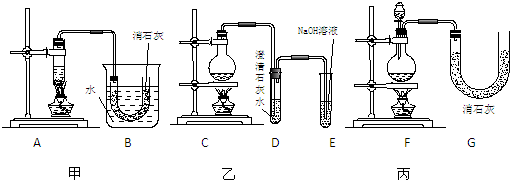
已知:温度稍高即发生如下副反应:6Cl
2+6Ca(OH)
2=Ca(ClO
3)
2+5CaCl
2+6H
2O
1.请写出制备氯气时发生反应的化学反应方程式,并用单线桥法表示出电子转移.
2.三位同学所设计的装置都有优点和缺点,请从你的角度分析甲同学装置的优缺点.优点:
.
缺点:
.请从上述装置的A-G的组成中选取合理的部分组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是
.
3.近几年欧美发达国家使用了一种更安全、高效的杀菌消毒物质二氧化氯.它对水中的重金属离子和氰化物都有很高的去除效果.二氧化氯可以将氰化物转化成两种空气成分气体.请写出过程中所发生反应的离子方程式:
.


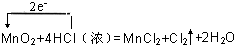 ,故答案为:
,故答案为: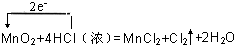 ;
;

 如图是某学生设计的制取和收集某些气体的实验装置(可加热).
如图是某学生设计的制取和收集某些气体的实验装置(可加热).