
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌ CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO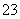 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO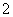 +4NH
+4NH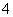 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO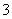 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硫酸工业生产过程的叙述错误的是
A.在接触室中使用铁粉作催化剂
B.在接触室中运用热交换技术可充分利用能源
C.把硫铁矿磨成细粉末,可以提高原料的利用率
D.该反应采用450-500℃主要是因为该温度下催化剂活性好
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
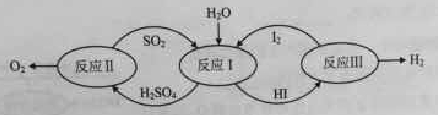
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
 ii SO3(g)分解。
ii SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关。下列说法不正确的是( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:

(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常压和500℃条件下,等物质的量的Ag2O,Fe(OH)3 ,NH4HCO3 ,NaHCO3完全分解,所得气体体积依次是V1\V2\V3\V4.体积大小顺序正确的是
A.V3>V2>V4>V1 B. V3>V4>V2>V1
C.V3>V2>V1>V4 D.V2>V3>V1>V4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com