
| A. | NaCl易溶于水 | B. | 熔融的NaCl能导电 | ||
| C. | NaCl不易分解 | D. | NaCl溶于水呈中性 |
分析 离子化合物:由阴阳离子构成的化合物,离子化合物在水溶液里或熔融状态下能电离出自由移动的离子,所以其水溶液或熔融态能导电,但是在水溶液里必须是其本身电离出自由移动的离子,不是与其它物质反应后的新物质电离出的离子,据此分析解答.
解答 解:A.易溶于水的化合物不一定是离子化合物,如氨气等,所以氯化钠易溶于水不能说明氯化钠是离子化合物,故A错误;
B.熔融的氯化钠能导电,说明氯化钠在熔融状态下能电离出自由移动的阴阳离子,所以能证明氯化钠是离子化合物,故B正确;
C.不易分解的化合物不一定是离子化合物,如硫酸等,所以氯化钠不易分解不能说明是离子化合物,故C错误;
D.水也呈中性但水是共价化合物,所以氯化钠溶于水呈中性,不能说明氯化钠是离子化合物,故D错误;
故选B.
点评 本题考查离子化合物的判断,为高频考点,明确离子化合物和共价化合物根本区别是解本题关键,根据熔融状态是否导电判断离子化合物和共价化合物.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
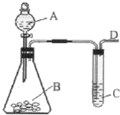 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 6 | ||
| C. | 2 | D. | 不可能出现此情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 mol/(L•s) | B. | 0.8 mol/(L•s) | C. | 1.6mol/(L•s) | D. | 2.4 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S不变,K变大,O2转化率增大 | B. | S不变,K变大,SO2转化率减小 | ||
| C. | S变小,K不变,O2转化率减小 | D. | S增大,K不变,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1(分离乙醇和乙酸) | B. | 图2(除去乙炔中的乙烯) | ||
| C. | 图3(除去溴苯中的溴单质) | D. | 图4(除去工业酒精中的甲醇) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com