
探究氯气的性质时,将干燥的有色布条和湿润的有色布条分别放入两个集气瓶中,同时通入氯气后,可观察到的现象为 ,该实验中起漂白作用的物质为_______________。在常温下,将氯气通入氢氧化钠溶液中可以得到漂白液(有效成分为NaClO),其反应的化学方程式为___________________________________。
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
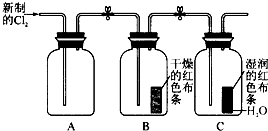 某学习小组设计了如图所示的实验方案来探究氯气的性质.
某学习小组设计了如图所示的实验方案来探究氯气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com