
【题目】高血脂严重影响人体徤康,化合物H是一种临床治疗高血脂症的药物。H的结构简式如图所示。
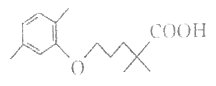
下列说法不正确的是( )
A. 有机物H含有的官能团只有羧基
B. 1mol H完全燃烧消耗19molO2
C. 有机物H是芳香化合物
D. 有机物H能和钠、碳酸氢钠反应
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
Ⅰ.A是石油裂解气的主要成分,A的产量通常是衡量一个国家石油化工水平的标准。
Ⅱ.2CH3CHO+O2→2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

请回答下列问题。
(1)写出A的结构简式:___。
(2)B物质的名称是___。
(3)E___(填“能或不能”)使酸性高锰酸钾溶液褪色
(4)写出下列反应方程式及反应类型:
②化学方程式__,反应类型___。
④化学方程式__,反应类型___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
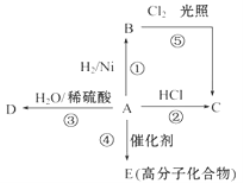
(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)除去B中混有的少量杂质A,所用的试剂为______________。
(4)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势,有望取代锂离子电池。最近,山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaxFeIIFeIII(CN)6+xNi3S2![]() 4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是

A.充电时,Na+被还原为金属钠
B.充电时,阴极反应式:xNa++FeIIFeIII(CN)6xe![]() NaxFeIIFeIII(CN)6
NaxFeIIFeIII(CN)6
C.放电时,NaxFeIIFeIII(CN)6为正极
D.放电时,Na+移向Ni3S2/Ni电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
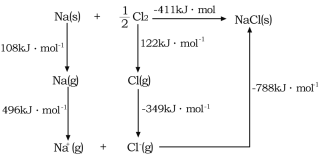
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
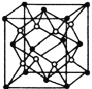
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A(如下图所示),短周期元素 X、Y、Z原子序数依次增大,其 中 Z位于第三周期。Z与 Y2可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于 X、Y、Z的叙述,正确的是
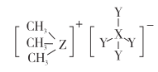
A.离子半径:Y >Z
B.氢化物的稳定性:X >Y
C.最高价氧化物对应水化物的酸性:X >Z
D.化合物 A中,X、Y、Z最外层都达到 8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com