
| A、反应开始时的速率:甲>乙 |
| B、反应所需时间:甲<乙 |
| C、反应开始时,酸的物质的量浓度:甲>乙 |
| D、反应结束时,pH:甲>乙 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在正极上发生氧化反应 |
| B、化学性质较活泼的一极为负极 |
| C、在外电路中电子流出的极为正极 |
| D、原电池是将电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、一定有SO
| ||||
B、SO
| ||||
| C、一定无Ag+ | ||||
D、可能有CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O |
| B、氢氧化钡与硫酸反应OH-+H+═H2O |
| C、铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag |
| D、氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
| B、在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D、相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ?mol-1,则H2的燃烧热为-241.8kJ?mol-1 | ||||||||||
B、已知:25℃时,
| ||||||||||
C、反应Fe(s)+5CO(g)?Fe(CO)5(g)的平衡常数表达式为K=
| ||||||||||
D、0.1mol?L-1的酒石酸(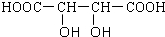 )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) )与0.1mol?L-1的NaOH混合后:c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-) | ||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com