
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
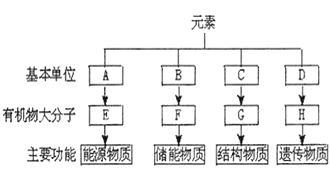
(1)E在动物细胞中是指____,在植物细胞中是指______;组成E的基本单位A是____,可用_____试剂检测。
(2)F是脂肪,可被苏丹Ⅲ染液染成____,脂质还包括____和____等。
(3)C是指______,大约有______种。
(4)生物体内的H主要集中在细胞核内的是______,组成H的基本单位D是_______。
(5)组成E、F、G、H四种有机物共有的元素有_____。
【答案】糖原淀粉葡萄糖斐林试剂橘黄色磷脂固醇氨基酸20脱氧核糖核酸(DNA)脱氧核苷酸C、H、O
【解析】
本题是对糖类、脂质、蛋白质、核酸的基本组成单位、元素组成和功能的考查,分析题图可知,E是能源物质,E可能是多糖,A是其基本组成单位葡萄糖;F是储能物质,F是脂肪,B是其基本组成单位甘油和脂肪酸;G是结构物质,G是蛋白质,C是其基本组成单位氨基酸;H是遗传物质,H应是核酸,D为其基本组成单位核苷酸。
(1)E是“有机物大分子”和“能源物质”,所以E是多糖,在动物细胞中E是糖原,在植物细胞中E是淀粉,多糖的基本单位A是葡萄糖,葡萄糖是还原糖性糖,与斐林试剂水浴加热出现砖红色沉淀。
(2)F是脂肪,可被苏丹Ⅲ染液染成橘黄色,被苏丹Ⅳ染成橘红色,脂肪是脂质中的一类,另外脂质还包括磷脂和固醇等。
(3)因为G是有机物大分子且是结构物质所以是蛋白质,其基本单位C是氨基酸,大约有20种。
(4)生物体内的主要集中在细胞核内的有遗传功能的有机物大分子是DNA,所以H是DNA,其基本组成单位是脱氧核糖核苷酸。
(5)组成蛋白质的元素C、H、O、N有的还含有P、S等,组成脂肪的元素C、H、O,多糖的组成元素是C、H、O,DNA的组成元素是C、H、O、N、P,所以组成E、F、G、H四种有机物共有的元素有C、H、O。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 F 是一种常见的化工原料,合成方法如下:
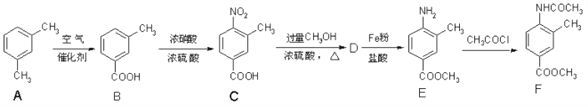
完成下列填空:
(1)化合物 C 中含氧官能团的名称是___________和__________。
(2)任写一种含苯环的 A 的同分异构体的结构简式: _________________。
(3)B→C 的反应类型是___________。
(4)写出 C→D 的化学方程式:_________________________________________。
(5)已知: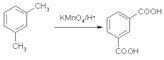 ,设计一条以
,设计一条以![]() 为原料合成
为原料合成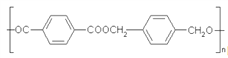 的合成路线。___________________。
的合成路线。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为不同化学元素组成的化合物的示意图,下列有关叙述中,正确的是
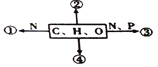
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
C. 若③为生物大分子,则其彻底水解的产物有4种
D. 若②大量积累于皮下和内脏器官周围,则②是磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有 __________个原子共平面;
(2)金刚烷的分子式为 ____________ ;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应①的产物名称是 __________,反应②的反应试剂和反应条件是 __________。
(4)已知烯烃能发生如下反应:

请写出下列反应产物的结构简式:
![]()
![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
18-Ⅰ
香茅醛(![]() )可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有_______。
)可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有_______。
A.分子式为C10H18O B.不能发生银镜反应
C.可使酸性KMnO4溶液褪色 D.分子中有7种不同化学环境的氢
18-Ⅱ
当醚键两端的烷基不相同时(R1-O-R2,R1≠R2),通常称其为“混醚”。若用醇脱水的常规方法制备混醚,会生成许多副产物:
R1—OH+ R2—OH ![]() R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
一般用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,某课外研究小组拟合成![]() (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
Ⅰ:![]()
Ⅱ:①![]()
②![]()
③![]()
回答下列问题:
(1)路线Ⅰ的主要副产物有______________、______________。
(2)A的结构简式为______________。
(3)B的制备过程中应注意的安全事项是______________。
(4)由A和B生成乙基苄基醚的反应类型为______________。
(5)比较两条合成路线的优缺点:______________。
(6)苯甲醇的同分异构体中含有苯环的还有________种。
(7)某同学用更为廉价易得的甲苯替代苯甲醇合成乙基苄基醚,请参照路线Ⅱ,写出合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:①该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
②牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水成分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是____________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
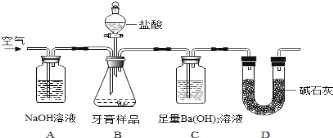
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有_______。
(3)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_____________________________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________。
(6)将等体积的AlCl3与NaOH溶液混合,充分反应后,测得混合溶液中含有铝元素质量是沉淀中含有铝元素质量的2倍,则c(AlCl3)与c(NaOH)的比值是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com